Химия - Новый полный справочник для подготовки к ОГЭ - 2018 год
Реакции ионного обмена и условия их осуществления
Так как электролиты в воде диссоциируют на ионы, то реакции между электролитами в растворе следует рассматривать как процесс взаимодействия соответствующих ионов. Вот почему в учебной литературе наряду с молекулярными уравнениями подобных реакций принято записывать ионные уравнения. Именно ионные уравнения реакций отражают суть тех изменений, которые происходят при взаимодействии веществ — электролитов.
При написании уравнений реакций в ионном виде следует помнить, что хорошо растворимые сильные электролиты записывают как набор ионов, образовавшихся при их полной диссоциации, в то время как неэлектролиты и слабые электролиты (а также газы и осадки) записывают в молекулярном виде.
Алгоритм составления ионного уравнения реакции может быть таким:
1. Записать молекулярное уравнение реакции и расставить коэффициенты.
2. Переписать это уравнение, записывая хорошо растворимые сильные электролиты в виде соответствующих ионов, а слабые электролиты, нерастворимые вещества и газы — в молекулярном виде.
3. Сократить одинаковые ионы в левой и правой частях уравнения и записать сокращённое ионное уравнение.
Примеры составления сокращённых ионных уравнений
1. Рассмотрим взаимодействие сульфата калия и нитрата бария. Молекулярное уравнение этой реакции выглядит так:
![]()
Все четыре соли являются сильными электролитами, даже нерастворимый сульфат бария. Но в соответствии с приведённым выше алгоритмом, сульфат бария (как нерастворимое вещество) запишем в молекулярном виде, в то время как все остальные соли представим в виде набора ионов, получающихся при их диссоциации:
![]()
И в левой, и в правой частях уравнения есть одинаковые ионы (NO3 и K+), сократим их:
![]()
Это и есть сокращённое ионное уравнение взаимодействия нитрата бария и сульфата калия. Видно, что сущность происходящей реакции заключается во взаимодействии ионов Ва2+ и SO42-, приводящем к образованию осадка сульфата бария.
2. Молекулярное уравнение взаимодействия азотной кислоты с гидроксидом рубидия запишется так:
![]()
В этом уравнении участвуют три сильных, хорошо растворимых электролита (HNO3, RbOH и RbNO3) и один очень слабый электролит (Н2O). В соответствии с алгоритмом формулу воды следует оставить в ионном уравнении, а вместо HNO3, RbOH и RbNO3 записать набор ионов, образующихся при их полной диссоциации:
![]()
После сокращения одинаковых ионов (они подчёркнуты) получим сокращённое ионное уравнение:
![]()
Таким образом, суть этой реакции состоит в связывании ионов H+ И ОН- С образованием слабого электролита — молекул воды. Точно так же запишется краткое ионное уравнение любой химической реакции между сильной кислотой и щелочью.
3. Запишем уравнение химической реакции между карбонатом калия и соляной кислотой:
![]()
В соответствии с алгоритмом формулы воды (слабого электролита) и углекислого газа оставим без изменений, в то время как формулы К2СO3, НСl и КСl — сильных электролитов — запишем в виде набора ионов:
![]()
Сократив одинаковые ионы, получим:
![]()
Из этого сокращённого ионного уравнения следует, что взаимодействие карбонат-ионов с ионами водорода приводит к образованию молекул воды (слабого электролита) и молекул углекислого газа.
Условия осуществления реакций ионного обмена
Реакции в растворах электролитов идут практически до конца в том случае, если происходит связывание исходных ионов с образованием:
— слабого электролита,
— осадка малорастворимого вещества,
— газообразного продукта.
Именно эти примеры мы и рассмотрели выше. Если в ходе реакции связывания ионов не происходит, то такие реакции не идут. Примером неосуществимых в растворе реакций могут быть:
![]()
В то же время, изменив условия протекания, можно заставить идти и, казалось бы, неосуществимую химическую реакцию. Так, в последнем случае реакция в растворе невозможна (все четыре вещества — сильные электролиты, полностью диссоциирующие на ионы). Но если взять твёрдый хлорид калия и концентрированную серную кислоту, реакция становится возможной:
![]()
В этом случае газообразный хлороводород удаляется из сферы реакции, и равновесие полностью смещается вправо. Именно так и получают хлороводород в лабораторном практикуме.
Задания
Часть 1
К каждому из заданий части 1 даны 4 варианта ответа, из которых только один правильный.
1. Реакции между нитратом бария и серной кислотой соответствует сокращенное ионное уравнение:
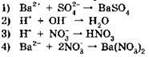
2. Взаимодействию соляной кислоты и едкого натра отвечает краткое ионное уравнение:
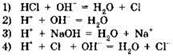
3. Взаимодействию азотной кислоты и едкого кали отвечает краткое ионное уравнение:
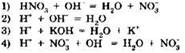
4. Взаимодействию нитрата серебра и хлорида натрия отвечает краткое ионное уравнение:
![]()
![]()
5. Взаимодействию серной кислоты и гидроксида бария отвечает краткое ионное уравнение:
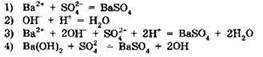
6. В водном растворе практически полностью взаимодействуют вещества:
![]()
7. Практически полностью в водном растворе взаимодействуют вещества:
![]()
8. Практически полностью в водном растворе взаимодействуют вещества:
1) серная кислота и карбонат калия
2) серная кислота и нитрат калия
3) серная кислота и хлорид калия
4) серная кислота и нитрат магния
9. Практически полностью в водном растворе взаимодействуют вещества:
1) нитрат серебра и хлороводород
2) нитрат кальция и хлорид калия
3) хлороводород и нитрат натрия
4) хлороводород и нитрат калия
10. Краткое ионное уравнение H+ + ОН- = Н2O отвечает взаимодействию веществ:
![]()
11. Краткое ионное уравнение H+ + ОН- = Н2O отвечает взаимодействию веществ:
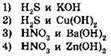
12. Выпадение осадка наблюдается при сливании растворов
1) хлорида алюминия и гидроксида кальция
2) сульфата натрия и соляной кислоты
3) карбоната калия и азотной кислоты
4) гидроксида натрия и серной кислоты
13. Выделение газа наблюдается при сливании растворов
1) сульфата натрия и гидроксида бария
2) гидроксида натрия и соляной кислоты
3) карбоната калия и азотной кислоты
4) гидроксида меди(II) и азотной кислоты
14. Верны ли следующие суждения о взаимодействии фосфата калия и серной кислоты в растворе?
А. При взаимодействии реагентов выпадает осадок.
Б. Взаимодействие реагентов сопровождается выделением газа.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
15. Сокращенное ионное уравнение
Fe2+ + 2OН- = Fe(OH)2
соответствует взаимодействию растворов веществ:
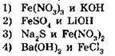
16. Сокращенное ионное уравнение
![]()
соответствует взаимодействию веществ:
1) оксида бария и раствора серной кислоты
2) бария и раствора сульфата меди(II)
3) растворов нитрата бария и сульфата натрия
4) растворов гидроксида бария и серной кислоты
17. Сокращенное ионное уравнение
H+ + ОН- = Н2O
соответствует взаимодействию веществ:
1) гидроксида калия (р-р) и серной кислоты (р-р)
2) гидроксида цинка и азотной кислоты (р-р)
3) гидроксида бария (р-р) и серной кислоты (р-р)
4) соляной кислоты и гидроксида меди(II)
18. Сокращенному ионному уравнению
H+ + ОН- = Н2O
соответствует молекулярное уравнение
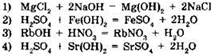
При выполнении заданий выберите правильные ответы.
19. Практически необратимо протекает взаимодействие растворов
1) гидроксида бария и серной кислоты
2) сульфата натрия и азотной кислоты
3) нитрата бария и хлорида калия
4) карбоната калия и соляной кислоты
5) сульфата магния и нитрата натрия
6) хлорида алюминия и гидроксида калия
Ответ: ____ .
20. Осадок выпадает при добавлении серной кислоты к раствору
1) карбоната калия
2) нитрата меди(II)
3) гидроксида бария
4) хлорида кальция
5) нитрата свинца(II)
6) гидроксида натрия
Ответ: ____ .