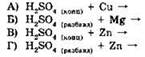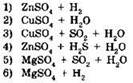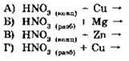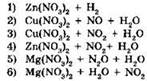Химия - Новый полный справочник для подготовки к ОГЭ - 2018 год
Химические свойства кислот - Химические свойства сложных веществ
В соответствии с теорией электролитической диссоциации, кислоты — сложные вещества, при диссоциации которых образуются катионы водорода и анионы кислотных остатков. Кислоты делятся на бескислородные и кислородсодержащие (последние можно рассматривать как гидроксиды, проявляющие кислотные свойства).
Химические свойства кислот, как правило, делят на общие (характерные для всех кислот) и специфические (характерные для конкретной кислоты).
Общие свойства кислот
Общие свойства кислот связаны с наличием в их водных растворах гидратированных ионов водорода, образующихся в процессе электролитической диссоциации:
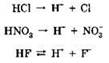
Так, все кислоты изменяют окраску индикаторов: лакмус приобретает красный цвет, метилоранж — розовый.
Все кислоты взаимодействуют с основаниями (растворимыми, нерастворимыми). Это — реакция нейтрализации:
![]()
В ходе этих реакций возможно образование не только средних, но и кислых или основных солей:
![]()
В случае нейтрализации сильной кислоты щелочью уравнение реакции нейтрализации запишется в кратком ионном виде как
![]()
Кислоты взаимодействуют с оксидами — основными и амфотерными. При этом образуются соль и вода:
![]()
Кислоты взаимодействуют с металлами, стоящими в ряду напряжений металлов до водорода, с образованием соли и водорода:
![]()
Взаимодействие с металлами азотной и концентрированной серной кислот будет рассмотрено в специфических свойствах кислот.
В некоторых случаях металлы не взаимодействуют с растворами кислот, хотя стоят в ряду активности металлов до водорода. Так, свинец не реагирует с разбавленной соляной кислотой, хотя растворяется в концентрированной. Это связано с тем, что образующийся в ходе реакции нерастворимый хлорид свинца покрывает металл плёнкой и защищает его от действия кислоты:
![]()
В случае концентрированной соляной кислоты происходит растворение хлорида свинца, с образованием комплексного соединения, и реакция становится возможной:
![]()
Кислоты могут взаимодействовать с солями. Этот тип реакций возможен в случае выделения газа, образования осадка или слабого электролита:
![]()
Некоторые кислоты могут разлагаться при нагревании, например:
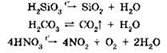
В заключение укажем, что кислоты могут участвовать не только в кислотно-основных, но и в окислительно-восстановительных реакциях.
Так, кислоты, содержащие элемент в низшей степени окисления, могут проявлять восстановительные свойства:
![]()
Напротив, кислоты, содержащие элемент в высшей степени окисления, могут проявлять окислительные свойства:
![]()
Специфические свойства серной кислоты
Концентрированная серная кислота обладает некоторыми специфическими свойствами. Так, она относится к эффективным водоотнимающим и осушающим средствам. Это свойство связано с образованием различных гидратов серной кислоты:
![]()
Поскольку образование гидратов связано с выделением значительного количества энергии, то при разбавлении серной кислоты следует соблюдать простое правило — приливать тонкой струйкой серную кислоту в воду при постоянном перемешивании, чтобы не допустить вскипания раствора.
Концентрированная серная кислота является довольно сильным окислителем, особенно при нагревании. Так, она окисляет бромид-, иодид-ионы, некоторые простые вещества (серу, уголь) и др.:
![]()
Концентрированная серная кислота может окислять некоторые малоактивные металы, стоящие в ряду активности после водорода (Сu, Hg, Ag). Поскольку окислителем в данном случае являются не ионы водорода H+ (как в разбавленном растворе кислоты), a cepa(VI), то в ходе реакции выделяется не водород, а продукты восстановления серы(VI): сероводород, диоксид серы, сера:
![]()
Концентрированная серная кислота не растворяет (пассивирует) такие металлы, как алюминий, железо, хром.
Качественной реакцией на серную кислоту и её соли является образование белого, нерастворимого в кислотах осадка при действии солей бария:
![]()
Специфические свойства азотной кислоты
Азотная кислота, особенно концентрированная, проявляет сильные окислительные свойства. Так, она окисляет сульфиды, сульфиты, многие простые вещества (иод, углерод, фосфор, серу) и т.д.:
![]()
Азотная кислота (даже разбавленная) растворяет многие малоактивные металлы (медь, серебро, ртуть). Поскольку азотная кислота, даже разбавленная, является окислителем за счёт азота (V), то продуктом её восстановления являются различные соединения азота: NO2, NO, N2O, N2, NH4. Водород, как правило, при взаимодействии металлов с азотной кислотой не выделяется. Состав продукта восстановления азотной кислоты зависит от концентрации азотной кислоты и активности металла. Схематически это может быть передано схемой:
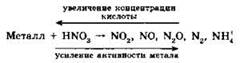
Из схемы видно, что вероятность выделения NO2 наибольшая в случае использования неактивного металла и концентрированной азотной кислоты. Напротив, образование ионов аммония возможно при растворении в очень разбавленной азотной кислоте активного металла:
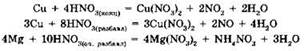
Концентрированная азотная кислота не растворяет (пассивирует) такие металлы, как алюминий, железо, хром.
Специфические свойства ортофосфорной кислоты
Ортофосфорную кислоту относят обычно к кислотам средней силы. Это связано с тем, что в разбавленных водных растворах степень её диссоциации по первой стадии достигает 30% (в то время как степень диссоциации слабых кислот не превышает 3—10%, а сильные кислоты диссоциируют практически нацело). По второй стадии степень диссоциации намного меньше, а по третьей — ничтожно мала. Результатом этого является исчезающе малая концентрация ионов РO43- в растворе Н3РO4. Так, при приливании раствора нитрата серебра к раствору Н3РO4 никакого осадка фосфата серебра не образуется, хотя Ag3PO4 относится к практически нерастворимым солям:
![]()
Для проведения качественной реакции на фосфорную кислоту её водный раствор предварительно нейтрализуют раствором аммиака:
![]()
а затем уже добавляют нитрат серебра.
Другой особенностью ортофосфорной кислоты является поведение её при нагревании. При 200 °С ортофосфорная кислота, частично обезвоживаясь, превращается в дифосфорную (или пирофосфорную кислоту):
![]()
При дальнейшем нагревании пирофосфорная кислота переходит в метафосфорную кислоту, что упрощённо описывает уравнение реакции:
![]()
Задания
Часть 1
К каждому из заданий части 1 даны 4 варианта ответа, из которых только один правильный.
1. С каждым из веществ, формулы которых ВаСl2 и СuО, будет взаимодействовать
1) соляная кислота
2) кремниевая кислота
3) азотная кислота
4) серная кислота
2. И с серебром, и с оксидом меди(II) будет реагировать
1) соляная кислота
2) фосфорная кислота
3) азотная кислота
4) угольная кислота
3. Электролитической диссоциации ортофосфорной кислоты по второй ступени отвечает уравнение:
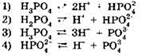
4. Электролитической диссоциации ортофосфорной кислоты по третьей ступени отвечает уравнение:
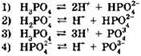
5. Сероводородная кислота реагирует с каждым из веществ:
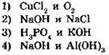
6. Водный раствор серной кислоты реагирует с каждым из двух веществ:
1) с железом и оксидом углерода(II)
2) с цинком и оксидом натрия
3) с алюминием и хлоридом натрия
4) с медью и гидроксидом калия
7. Разбавленная соляная кислота реагирует с каждым из веществ:
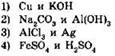
8. Концентрированная серная кислота при комнатной температуре не действует на
1) Na
2) Аl
3) Zn
4) Mg
9. Водный раствор фосфорной кислоты реагирует с каждым из веществ:
![]()
10. Концентрированная серная кислота при комнатной температуре не действует на
1) Mg
2) Na
3) Fe
4) К
11. Различить серную и соляную кислоты можно, если
1) поместить в них кусочек цинка
2) добавить раствор фенолфталеина
3) добавить раствор метилоранжа
4) прилить раствор нитрата бария
12. В отличие от серной кислоты угольная кислота
1) является сильной кислотой
2) не взаимодействует с NaOH
3) легко разлагается
4) взаимодействует с содой
13. Ни серная, ни фосфорная кислоты не реагируют с
1) КОН
2) Аl
3) НСl
4) Na2S
14. Уксусная кислота не взаимодействует
1) оксидом кальция
2) гидроксидом натрия
3) оксидом серы(IV)
4) карбонатом натрия
15. Для серной кислоты справедливо высказывание:
1) плотность серной кислоты примерно равна 1 г/мл
2) серная кислота — легкоподвижная жидкость
3) растворение кислоты в воде сильно экзотермично
4) серная кислота не действует на цинк и медь
16. Соляная кислота при обычных условиях взаимодействует с
1) сульфатом бария.
2) углеродо.
3) железом
4) медью
17. Концентрированная азотная кислота при обычных условиях не взаимодействует с
1) магнием
2) железом
3) гидроксидом натрия
4) оксидом магния
18. Концентрированная азотная кислота при обычных условиях не взаимодействует с
1) цинком
2) гидроксидом алюминия
3) оксидом кальция
4) алюминием
19. Реакция нейтрализации происходит между
1) цинком и соляной кислотой
2) серной кислотой и хлоридом бария
3) гидроксидом кальция и азотной кислотой
4) гидроксидом натрия и сульфатом меди
20. Раствор серной кислоты реагирует с каждым из двух веществ:
1) Na2SO3 и HNO3
2) FeO и NaNO3
3) Сu и Сu(ОН)2
4) Fe и Fe2O3
21. Разбавленная серная кислота может реагировать с каждым из двух веществ:
1) серой и оксидом железа(III)
2) оксидом цинка и оксидом кремния(IV)
3) гидроксидом калия и хлоридом натрия
4) нитратом кальция и гидроксидом меди(II)
22. Как гидроксид алюминия, так и соляная кислота могут взаимодействовать с
1) СuО .
2) КОН
3) СO2 .
4) H2S
При выполнении заданий выберите правильные ответы. Установите соответствие.
23. Серная кислота реагирует с
1) хлороводородом
2) углекислым газом
3) оксидом углерода(II)
4) сульфидом натрия
5) ртутью
Ответ: ____ .
24. Азотная кислота реагирует с
1) Ag
2) Au
3) СO2
4) FeS
5) SiO2
Ответ: ____ .
25. И серная, и соляная кислоты реагируют с
1) Ag
2) CuS
3) K2S
4) Al
5) ВаСl2
Ответ: ____ .
26. И серная кислота, и сульфат натрия реагируют с
1) гидроксидом калия
2) цинком
3) нитратом бария
4) гидроксидом железа(III)
5) хлоридом кальция
Ответ: ____ .
27. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
|
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
|
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
|
|
А |
Б |
В |
Г |
28. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
|
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
|
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
|
|
А |
Б |
В |
Г |