Химия - Новый полный справочник для подготовки к ОГЭ - 2018 год
Химические свойства солей (средних) - Химические свойства сложных веществ
Соли — сложные вещества, при диссоциации которых в водном растворе образуются катионы металлов и анионы кислотных остатков. Химические свойства солей определяются природой катиона и аниона, из которых соль образована.
В водных растворах или расплавах соли диссоциируют на составляющие ионы:
![]()
Как правило, соли являются сильными электролитами. Это справедливо и для таких солей, как BaSO4, Са3(РO4)2, CaF2, и других, относящихся к практически нерастворимым. На самом деле сульфат бария имеет небольшую растворимость в воде, равную 10-5 моль/л, или 0,23 мг на 100 мл воды. И тот сульфат бария, который перешёл в раствор, находится в полностью диссоциированном состоянии:
![]()
Если для всех кислот типичными были свойства, связанные с присутствием ионов ЕГ В ВОДНОМ растворе, а для оснований — с ионами ОН-, то для солей таких типичных свойств нет: слишком различаются соли по своему качественному составу и химическому поведению. В то же время, некоторые из реакций с участием солей мы выделим ниже.
1. Соли могут вступать в реакции ионного обмена с кислотами, основаниями и другими солями. Непременным условием возможности таких реакций является выделение газа, образование осадка или малодиссоциирующего соединения (слабого электролита). Рассмотрим примеры таких реакций:
— вытеснение слабой кислоты из её соли под действием более сильной кислоты:
![]()
— образование осадка малорастворимого основания при действии щёлочи на соль:
![]()
— выделение газообразного продукта в ходе реакции:
![]()
— образование осадка при взаимодействии двух солей:
![]()
В ряде случаев при взаимодействии солей с кислотами или основаниями могут получиться кислые или основные соли, например:
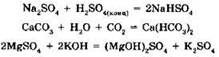
2. Соли могут вступать в реакции замещения с металлами. В ходе этих реакций более активный металл вытесняет менее активный из раствора его соли:
![]()
Для предсказания возможности таких реакций необходимо использовать ряд стандартных электродных потенциалов (ряд активности металлов), фрагмент которого приведён ниже:
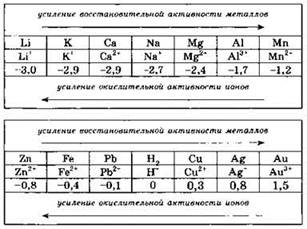
В этом ряду металлы расположены в порядке уменьшения химической активности — от щелочных и щелочноземельных металлов к благородным и платиновым металлам. Так, металлический свинец может вытеснять из солей такие металлы, как медь, серебро, золото. В свою очередь, свинец может быть выделен из своих солей под действием магния, марганца, цинка.
Следует отметить, что не всегда возможна ожидаемая реакция вытеснения одного металла другим на основании положения этих металлов в ряду напряжений. Так, металлический калий при внесении в раствор хлорида цинка в первую очередь будет взаимодействовать с водой с образованием щелочи:
![]()
Образовавшаяся щелочь с солью цинка даст осадок гидроксида цинка:
![]()
Таким образом, выделения цинка происходить не будет.
Реакции вытеснения одних металлов другими могут идти не только в растворе. Так, первый металлический алюминий был получен вытеснением алюминия калием из расплавленного хлорида алюминия:
![]()
Металлический калий, в свою очередь, в промышленности получают взаимодействием хлорида калия и натрия:
![]()
Эта примечательная реакция становится возможной при температуре выше 850 °С. Пусть вас не смущает, что в данном случае менее активный в стандартных условиях натрий вытесняет более активный калий из его соли. При 850 °С стандартный ряд активности металлов уже не работает. Дело в том, что металлический калий более летуч по сравнению с натрием, калий испаряется, уходит из сферы реакции, и равновесие смещается вправо, в сторону образования калия.
3. Соли могут участвовать в окислительно-восстановительных реакциях. Одни соли проявляют сильные восстановительные свойства, другие — окислительные. Сильными восстановителями являются SnCl2, СrСl2, FeCl2, CuCl, K2S, K2SO3 и др. Окислительные свойства проявляют KMnO4, K2Cr2O7, KNO3, КСlO3 и др. Примеры окислительно-восстановительных реакций с участием солей:
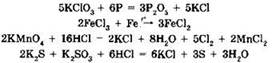
4. Некоторые соли (главным образом соли кислородсодержащих кислот) разлагаются при нагревании. К таким солям относятся карбонаты, нитраты, перманганаты, хлораты, перхлораты, дихроматы и др.:
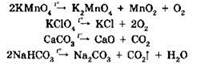
Если первые две реакции относятся к окислительно-восстановительным, то две последние происходят без изменения степеней окисления.
Разлагаются при нагревании и соли бескислородных кислот, например галогениды:
![]()
5. Некоторые соли могут взаимодействовать с кислотными оксидами:
![]()
В первой реакции при взаимодействии сульфата натрия и оксида серы(VI) образуется дисульфат (или пиросульфат) натрия — соль дисерной кислоты Na2S2O7, входящей в состав олеума. Во второй реакции диоксид кремния вытесняет более летучий диоксид углерода из силиката калия.
Задания
Часть 1
К каждому из заданий части 1 даны 4 варианта ответа, из которых только один правильный.
1. С раствором нитрата меди(II) может взаимодействовать
1) цинк
2) гидроксид железа(III)
3) оксид кремния(IV)
4) углерод
2. Хлорид железа(II) в водном растворе может реагировать с
1) K2S .
2) СO2 .
3) SiO2
4) Сu
3. Нитрат меди(II) при нагревании переходит в
1) Сu .
2) CU3N2 .
3) CU(NO2)2
4) СuО
4. Сульфат меди(II) в водном растворе не реагирует с
1) Ba(NO3)2.
2) Fe .
3) NaOH
4) H2SiO3
5. При термическом разложении нитрата калия образуется
1) KNO2
2) К2O .
3) K3N
4) К
6. В отличие от сульфата натрия сульфат меди(II) реагирует с
1) водой .
2) хлоридом бария.
3) нитратом кальция
4) гидроксидом калия
7. Не реагирует с разбавленной серной кислотой каждое из двух веществ:
1) сульфат натрия и хлорид бария
2) хлорид натрия и хлорид калия
3) карбонат калия и хлорид калия
4) хлорид бария и нитрат калия
8. Сульфат натрия реагирует с
1) КОН
2) Ва(ОН)2
3) NaCl
4) Н2СO3
9. Не реагирует с разбавленной азотной кислотой каждое из двух веществ:
![]()
10. Соль не образуется в ходе реакции
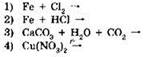
11. Хлорид меди(II) не реагирует с
1) H2S .
2) K2S .
3) H2CO3
4) AgNO3
При выполнении заданий выберите правильные ответы. Установите соответствие.
12. Сульфат алюминия реагирует с
1) водой .
2) серебро.
3) нитратом калия
4) едким натром
5) серой
Ответ: ____ .
13. С раствором сульфата меди(II) реагируют:
1) соляная кислота
2) водород
3) алюминий
4) гидроксид бария
5) оксид кремния
Ответ: ____ .
14. Хлорид бария реагирует с
![]()
Ответ: ____ .
15. И гидроксид калия, и хлорид бария реагируют с
![]()
Ответ: ____ .
16. И серная кислота, и сульфат натрия реагируют с
1) гидроксидом калия
2) цинком
3) нитратом бария
4) гидроксидом железа(III)
5) хлоридом кальция
Ответ: ____ .