Химия - Новый полный справочник для подготовки к ОГЭ - 2018 год
Правила безопасной работы в школьной лаборатории. Лабораторная посуда и оборудование. Разделение смесей и очистка веществ. Приготовление растворов
Правила безопасной работы в школьной лаборатории
Работа в химической лаборатории часто связана с использованием вредных, ядовитых или опасных в пожарном отношении соединений. Поэтому с самого начала вы должны безукоснительно соблюдать правила техники безопасности при работе в лаборатории — как при выполнении отдельных лабораторных опытов, так и при выполнении практических работ.
Прежде всего, никогда не работайте в химической лаборатории в одиночестве. Рядом обязательно должен быть человек, который при необходимости сможет оказать вам помощь. В то же время посторонние лица могут находиться в химическом кабинете только с разрешения учителя химии.
Во время работы учащиеся должны находиться в халатах, соблюдать чистоту и порядок на рабочем месте. В лаборатории работайте вдумчиво. Не приступайте к выполнению опыта, не уяснив, что и как нужно делать и к каким последствиям это может привести. До проведения эксперимента подробно по учебнику изучите порядок его проведения. Строго соблюдайте все указания учителя по безопасному обращению с реактивами, химической посудой, нагревательными приборами. Запрещается проводить опыты, не предусмотренные в данной работе.
Помните, что стеклянная посуда хрупкая. При небрежном обращении она может быть разбита, а осколки стекла могут поранить руки. В случае порезов немедленно обратитесь к учителю. Обо всех неполадках в работе оборудования сразу ставьте в известность учителя или лаборанта.
В химической лаборатории категорически запрещен приём пищи.
Не пробуйте вещества на вкус. Знакомьтесь с запахом веществ осторожно, лёгким движением руки направляя воздух от сосуда к носу (рис. 21).
Все работы, связанные с выделением вредных паров или газов, следует проводить только в вытяжном шкафу.
Берите для опытов реактивы не больше того количества, которое указано в рекомендациях к опыту. Не следует излишки взятых веществ высыпать (или выливать) обратно в банки с реактивами. Никогда не прикасайтесь к реактивам рукой. Твёрдые вещества берите из банки ложкой, шпателем или сухой пробиркой. Жидкие вещества и растворы приливаются для опытов понемногу, по 1—2 мл. Склянка с жидкостью берётся таким образом, чтобы рука была сверху этикетки. Перемешивается жидкость с помощью стеклянной палочки.
При попадании на кожу растворов кислот или щелочей необходимо смыть их сильной струёй холодной воды, а затем обработать нейтрализующим раствором (2%-ным раствором соды или уксусной кислоты) и ополоснуть водой.
Запрещается выливать в канализацию использованные растворы, используйте для этого специальные ёмкости.
При проведении опытов с нагреванием помните, что зажигать спиртовку или газовую горелку разрешается только от спички. Наполняйте пробирки раствором не более чем на одну треть. Отверстие нагреваемой пробирки должно быть направлено в сторону от себя и соседей. Начинайте нагревание со слабого прогрева всей пробирки и только затем ведите дальнейший нагрев вещества. Не держите нагреваемую посуду руками — используйте для этой цели тигельные щипцы или пробиркодержатель.
Осторожно обращайтесь с огнем. Запрещается оставлять нагревательные приборы без присмотра. Если произошло возгорание, то позовите учителя. Вспыхнувшие реактивы засыпаются песком или накрываются влажным полотенцем. Вспыхнувшая одежда тушится с помощью одеяла, которое имеется в любой химической лаборатории.
После окончания опыта уберите рабочее место и вымойте посуду.
Все эти правила могут быть изложены и в шуточной форме, как это было сделано в одном из номеров журнала “Химия и жизнь”. Прочитайте инструкцию, которая в запоминающейся форме регламентирует порядок работы в химической лаборатории.
Правила поведения в химической лаборатории
• Если вы откупорили что-либо — закупорьте!
• Если в руках у вас жидкое — не разлейте, порошок — не рассыпьте, газообразное — не выпустите наружу!
• Если включили — выключите!
• Если открыли, — закройте!
• Если разобрали — соберите!
• Если не можете собрать — позовите на помощь!
• Если не разбирали, то и не вздумайте собирать!
• Если одолжили что-либо — верните!
• Если пользуетесь чем-нибудь — держите в чистоте и порядке!
• Если сдвинули что-нибудь — верните на место!
• Если не знаете, как это действует, не трогайте!
• Если не можете понять что-либо — почешите в затылке!
• Если вы всё же не поймёте, то и не пытайтесь!
• Если что-либо взорвалось, проверьте: осмотрите себя и убедитесь, что помощь не нужна!
• Если вы не усвоили этих правил, не входите в лабораторию!
Лабораторная посуда и оборудование
При выполнении химических опытов используется различная лабораторная посуда и специальное оборудование. Химическая посуда изготовляется обычно из специального стекла, устойчивого к перепадам температуры и действию агрессивных реагентов (кислот и щелочей). Используется также посуда, изготовленная из фарфора (и других огнеупорных материалов), а также из полимерных материалов (полиэтилена, тефлона и др.).
Пробирки используют для проведения экспериментов с небольшими количествами реактивов (рис. 22).

В пробирках проводят опыты как с сухими веществами, так и с водными растворами. В химических пробирках можно нагревать вещества.
Стаканы различной ёмкости обычно изготовляют из термостойкого стекла и используют, как правило, для вспомогательных работ (чаще с водными растворами) (рис. 23).

Колбы применяют при проведении самых различных экспериментов. Они бывают круглодонными, плоскодонными и коническими. Плоскодонные и конические колбы используют при перегонке жидкостей, для хранения растворов.
В ряде случаев используют фарфоровую посуду: стаканы, выпаривательные чашки, ступки для измельчения твёрдых веществ (рис. 24, 25).

Холодильники служат для охлаждения и конденсации паров, образующихся при кипении или перегонке жидкостей (рис. 26).
Стеклянные воронки используют в процессе переливания жидкостей из одного сосуда в другой, а также при фильтровании растворов (рис. 27).
Делительные воронки (рис. 28) применяют для разделения несмешивающихся жидкостей или проведения процесса экстракции, По конструкции делительные воронки близки к капельным воронкам, используемым для постепенного приливания жидкости к реакционной смеси.
Эксикаторы — ёмкости из толстостенного стекла, предназначенные для высушивания твёрдых веществ (рис. 29).

Эксикатор заряжается высушивающим веществом (например, плавленой щёлочью, концентрированной серной кислотой, фосфорным ангидридом).
Мерные цилиндры и мензурки используют для отмеривания приблизительных объёмов жидкостей (рис. 30, 31). Для точного отмеривания объёма используют специальные химические пипетки и бюретки.
Мерные колбы предназначены для приготовления растворов с точной концентрацией. На их удлинённой шейке имеется кольцевая черта, отвечающая определённому объёму (рис. 32).

Вещества из реактивных склянок следует брать с помощью шпателей — лопаточек, сделанных из металла, фарфора, пластмассы (рис. 33).

Термометры (ртутные и спиртовые) используют для определения температуры растворов (рис. 34).
Для проведения экспериментов, связанных с нагреванием, используют следующие нагревательные приборы: спиртовки (рис. 35), газовые горелки (рис. 36), электрические нагреватели.

При работе с газовыми горелками необходимо особенно строго соблюдать правила техники безопасности. Органические вещества и растворители нельзя нагревать на открытом пламени, для их нагрева используют асбестированную сетку, электроплитку с закрытой спиралью или водяную баню.
Для надёжного закрепления деталей или узлов приборов используют лабораторные штативы, снабжённые зажимными “лапками”, муфтами, кольцами (рис. 37).

В лабораторном практикуме 9 класса предусмотрены опыты по получению некоторых газов, а также по разделению (очистке) веществ с помощью некоторых простейших методов.
Разделение смесей и очистка веществ
Способы разделения смесей и очистки веществ основаны на различиях в физических свойствах компонентов смеси.
Отстаивание применяют для разделения неоднородной смеси двух нерастворимых веществ, обладающих различной плотностью. Частицы вещества с большей плотностью постепенно оседают на дно, в то время как другое вещество собирается на поверхности или оказывается равномерно распределённым в толще воды. Отстаиванием можно разделить и две несмешивающиеся жидкости, например бензин и воду или воду и растительное масло. В лаборатории для этих целей используют делительную воронку.
Фильтрование используют для очистки жидкости от нерастворимых в ней веществ (рис. 38).
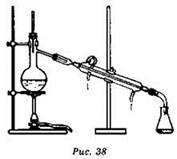
Жидкость постепенно просачивается через фильтр, а частички примесей задерживаются на нём. В качестве фильтра используют фильтровальную бумагу, плотную ткань, специальные фильтровальные устройства.
Выпаривание применяют для выделения твёрдых веществ из раствора. Часто выпаривание сочетают с кристаллизацией, основанной на различной растворимости веществ при разных температурах.
Дистилляция (перегонка) основана на различии в температурах кипения компонентов смеси. Для разделения смесей методом перегонки используют простейшую установку, состоящую из круглодонной колбы с отводом (колбы Вюрца), термометра, нисходящего холодильника, аллонжа и приёмника (рис. 39).

Очистка жидкости достигается путём нагревания её до кипения с последующей конденсацией образовавшихся паров в виде дистиллята в стеклянном нисходящем холодильнике.
Экстракцию применяют в тех случаях, когда вещество лучше растворяется в органических растворителях по сравнению с водой. Если долго встряхивать сосуд, в котором смешаны аптечная йодная настойка и бензол С6Н6, то через некоторое время окраска водного раствора иода побледнеет, а бензольный слой окрасится в фиолетовый слой, характерный для молекулярного иода. В данном опыте произошла экстракция иода из водной фазы в бензольную, т.к. растворимость иода в С6Нб значительно превышает растворимость иода в воде. Для проведения процесса экстракции часто используют делительную воронку, с помощью которой удобно разделять два слоя — органический и водный.
Возгонка (сублимация) — переход вещества из кристаллического состояния в парообразное (минуя жидкое). При охлаждении пары вновь конденсируются с образованием твёрдого сублимата. Этим способом хорошо очищаются вещества, летучесть которых заметно отличается от летучести примесей. Для возгонки используют фарфоровую чашку (4), в которую помещают очищаемое вещество, и стеклянную воронку (3), которой накрывают чашку. Отверстие воронки закрывают ватным тампоном (2), а между чашкой и воронкой помещают фильтровальную бумагу (1) с проделанными в ней несколькими отверстиями (рис. 40).
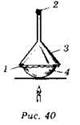
Таким образом в лаборатории можно очищать иод. Иод при нагревании испаряется из чашки и вновь оседает на холодных частях воронки.
Особым методом разделения компонентов, основанным на различной поглощаемости их определенным веществом (адсорбентом), является хроматография. С помощью хроматографии русский ботаник М.С. Цвет впервые выделил хлорофилл из зеленых частей растений. В промышленности и лабораториях в качестве адсорбента для хроматографии используют силикагель, уголь, оксид алюминия.
Приготовление растворов
Чаще всего в химической лаборатории приходится работать не с индивидуальными веществами (кислотами, основаниями, солями), а с их водными растворами. Не все вещества одинаково растворяются в воде. Для характеристики способности вещества растворяться используют понятие “растворимость”. Растворимость численно равна массе вещества, которая максимально может раствориться в 100 г растворителя при данной температуре.
Растворимость веществ меняется в самых широких пределах. Есть вещества хорошо растворимые, к ним относятся серная кислота и спирт (смешиваются с водой в любых соотношениях), поваренная соль, селитра, сахароза (растворимость сахарозы составляет 200 г на 100 г воды). Есть вещества малорастворимые, например гидроксид магния, гипс (0,2 г гипса на 100 г воды). Есть вещества практически нерастворимые, например мел, сульфат бария, хлорид серебра (растворимость AgCl составляет 0,15 мг на 100 г воды). В большинстве случаев растворимость веществ с ростом температуры возрастает. Однако растворимость гипса, гидроксида кальция и всех газов с ростом температуры уменьшается. Насыщенным называется раствор, в котором указанное вещество при данной температуре больше не растворяется. Концентрированным называется раствор, в котором содержание растворённого вещества довольно велико. Напротив, если содержание вещества в растворе мало, раствор называется разбавленным.
Для количественной характеристики содержания растворённого вещества в растворе обычно используют две величины — массовую долю и молярную концентрацию.
Массовая доля вещества X в растворе равна отношению массы растворённого вещества к массе всего раствора:
![]()
Массовая доля величина безразмерная и выражается в долях от единицы или в процентах. Так, если 5 г КОН растворить в 70 г воды, то получится раствор с массовой долей щёлочи, равной:
ω(КОН) = 5/75 = 0,067, или 6,7%.
Напомним, что в знаменателе стоит масса раствора, которая складывается из масс растворённого вещества и растворителя, в данном случае m(р-ра) = 5 + 70 = 75 г.
Молярная концентрация равна отношению количества растворённого вещества к объёму раствора:
![]()
Молярная концентрация имеет размерность моль/л. Очень часто вместо моль/л используют краткое обозначение “М”.
Так, если в 2 л раствора содержится 49 г серной кислоты (0,5 моль), такой раствор будет иметь молярную концентрацию, равную
c(H2SO4) = 0,5/2 = 0,25 моль/л.
На склянке с таким раствором должна быть этикетка: c(H2SO4) = 0,25 моль/л или 0,25М H2SO4
При приготовлении заданного раствора поступают так.
Пример 1. Пусть необходимо приготовить 400 г раствора соли, массовая доля NaCl в котором равна 5%.
1. Рассчитаем, сколько надо взять воды и соли:
![]()
2. На весах отвешиваем 20 г соли и переносим её в стеклянный стакан. Мензуркой или мерным цилиндром отмериваем 380 мл дистиллированной воды, вливаем её в стакан с солью и перемешиваем стеклянной палочкой до полного растворения соли.
Пример 2. Пусть необходимо приготовить 0,5 л 0,2М раствора нитрата калия.
1. Рассчитаем, сколько надо взять соли:
![]()
2. Взвешиваем на весах 10,1 г нитрата калия и количественно переносим соль в мерную колбу объёмом 500 мл.
3. Наливаем в колбу до половины дистиллированной воды и перемешиваем содержимое до полного растворения соли. После этого аккуратно доливаем в колбу дистиллированную воду до круговой метки на горле колбы. После этого закрываем колбу пробкой и перемешиваем раствор ещё раз.
Задания
Часть 1
К каждому из заданий части 1 даны 4 варианта ответа, из которых только один правильный.
1. Находясь в химической лаборатории, можно
1) проводить опыты только с разрешения учителя
2) проводить любые опыты, предупредив об этом одноклассников
3) пробовать вещества на вкус
4) зажигать спиртовку от другой горящей спиртовки.
2. При попадании на кожу рук раствора щёлочи необходимо
1) нейтрализовать её раствором серной кислоты
2) тщательно обработать кожу рук содой
3) промыть кожу мылом
4) смыть щёлочь большим количеством воды, а затем нейтрализовать раствором борной кислоты
3. В лабораторных условиях можно перелить из одного стакана в другой газ, который называется
1) кислоро.
2) оксид углерода(II.
3) оксид углерода(IV)
4) метан
4. Калий хранят под слоем керосина, потому что он
1) мягкий, легко режется ножом
2) быстро окисляется кислородом
3) на воздухе испаряется
4) взаимодействует с азотом воздуха
5. Веществом, неядовитым для человека, является
1) N2
2) H2S 3) С. 4) Сl2 6. При работе с хлором соблюдают специальные меры безопасности, потому что он 1) летуч 2) токсичен 3) разъедает стекло 4) образует взрывоопасные смеси с воздухом 7. Ядовитым газом является 1) Сl2
2) СO2 3) H2
4) N2
8. Формула соединения углерода, проявляющего токсичные свойства, 1) NaHCO3 . 2) Na2CO3 . 3) СаСO3 4) СО 9. Ядовитым является вещество, формула которого 1) СаСl2 ∙ 2Н2. 2) Na2SO4 ∙ 10Н2O 3) Na2CO3 4) HgCl2 10. При растворении в 200 г воды 20 г сахарозы получится раствор с массовой долей растворённого вещества, равной 1) 9% 2) 10. 3) 20. 4) 18% 11. При растворении 10 г соли в 10 г воды получится раствор с массовой долей растворённого вещества, равной 1) 50. 2) 10. 3) 20. 4) 1% 12. Какое из веществ оказывает на организм человека наркотическое действие? 13. Верны ли следующие суждения о свойствах концентрированной серной кислоты? А. Серная кислота обугливает органические вещества, отнимая от них воду. Б. Попадание кислоты на кожу приводит к тяжёлым ожогам. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 14. Верны ли следующие суждения о фосфоре? А. Белый фосфор ядовит и даёт труднозаживающие ожоги. Б. Фосфор — необходимый элемент в организме человека. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 15. Взрывчатые смеси с воздухом образует 1) бром . 2) бромоводород 3) тетрахлорид углерода. 4) ацетилен 16. Экологически чистым топливом является 1) водород. 2) нефть 3) каменный уголь. 4) природный газ 17. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории? А. Мерный цилиндр нельзя использовать для нагревания раствора кислоты. Б. С разрешения учителя в школьной лаборатории можно работать одному. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 18. Верны ли следующие суждения об обращении с растворами щелочей? А. При попадании раствора щелочи на кожу рук его надо смыть водой, а затем обработать раствором борной кислоты. Б. При попадании раствора щелочи на кожу рук его надо смыть раствором соды. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 19. Верны ли следующие суждения об обращении с газами в процессе лабораторных опытов? А. Прежде, чем поджечь водород, его необходимо проверить на чистоту. Б. Получаемый из бертолетовой соли кислород нельзя определить по запаху. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 20. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории? А. В мензурке можно нагревать воду. Б. Горящий натрий можно тушить водой. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны Часть 2 Дайте полный развёрнутый ответ на задания части 2. 21. К 220 г раствора серной кислоты с массовой долей 95% добавили 120 г воды. Массовая доля кислоты в полученном растворе равна _______ %. (Запишите число с точностью до десятых.) 22. К 150 г раствора нитрата бария с массовой долей 5% добавили 120 г раствора той же соли с массовой долей 12%. Массовая доля соли в полученном растворю равна _______ %. (Запишите число с точностью до целых.) 23. К 250 г раствора азотной кислоты с массовой долей 20% добавили 120 г раствора той же кислоты с массовой долей 15%. Массовая доля кислоты в полученном растворе равна _______ %. (Запишите число с точностью до десятых.) 24. Для получения 10%-ного раствора хлорида аммония необходимо к 200 г раствора с массовой долей 4% добавить твёрдую соль массой _______ г. (Запишите число с точностью до десятых.)