Химия - Новый полный справочник для подготовки к ОГЭ - 2018 год
Вычисление количества вещества, массы или объёма вещества по количеству вещества, массе или объёму одного из реагентов или продуктов реакции - Проведение расчётов на основе формул и уравнений реакций
Расчёты по уравнениям химических реакций занимают важное место при изучении химии. Все подобные расчёты основаны на законе сохранения массы веществ: в ходе химической реакции масса веществ, вступивших в реакцию, равна массе веществ, полученных в ходе реакции. Этот закон объясняется исходя из атомно-молекулярного учения: в ходе реакций не изменяется общее число атомов каждого элемента, просто происходит перегруппировка атомов с образованием новых веществ.
Решение химических задач предполагает использование понятий “количество вещества” и “моль”. Действительно, в химии взаимодействуют друг с другом не граммы и килограммы, а атомы и молекулы, число которых подсчитывают с использованием количества вещества, выражающегося в молях.
Разобьём задачи по уравнениям химических реакций на несколько типов.
Вычисление количества вещества
При решении любых подобных задач следует в первую очередь записать уравнение химической реакции и внимательно его прочитать. К сожалению, многие школьники не могут читать уравнения реакций и не видят той информации, которая скрыта в них.
Пусть дано уравнение реакции:
2Р + 3Сl2 = 2РСl3
Многие из вас читают уравнение химической реакции следующим образом:
“Два пэ плюс три хлор-два получается два пэ-хлор-три”.
Прочитав уравнение таким образом, вы не сможете получить из него никакой полезной информации для решения задачи. Вы забыли о количественных отношениях между веществами — участниками реакции. Посмотрите, как можно (и нужно!) читать химические уравнения (отражая и качественную, и количественную информацию, заключающуюся в них):
“При взаимодействии фосфора с хлором образуется трихлорид фосфора” (качественная информация);
“При взаимодействии двух атомов фосфора с тремя молекулами хлора образуются две молекулы трихлорида фосфора” (количественная информация);
“При взаимодействии двух молей атомов фосфора с тремя молями молекул хлора образуются два моля трихлорида фосфора”.
Вспомнив значения молярных масс реагентов и продукта реакции, прочитаем по-другому:
“При взаимодействии 62 г фосфора с 213 г хлора об разуются 275 г трихлорида фосфора”.
И наконец, учитывая то, что хлор при нормальных условиях — газ и что 1 моль газа занимает при н.у. объём 22,4 л, прочитаем:
“При взаимодействии 62 г фосфора с 67,2 л хлора образуются 275 г трихлорида фосфора”.
В таких суждениях содержится уже половина ответа к любой расчётной задаче. Покажем это на примерах.
Пример 1. Вычислите количество вещества натрия, которое без остатка прореагирует с хлором, объём которого при н.у. равен 8,96 л.
Решение. Прежде всего запишем уравнение реакции и прочитаем его:
2Na + Сl2 = 2NaCl
“При взаимодействии двух молей атомов натрия с одним молем молекул хлора образуются два моля хлорида натрия”.
Итак, по уравнению реакции всегда 2 моль Na реагируют без остатка с 1 моль Сl2.
В условии задачи говорится, что объём хлора равен 8,96 л. Поэтому следующим действием будет нахождение количества вещества хлора. Между количеством вещества газа n, его объёмом V и молярным объёмом Vm существует простая зависимость:
![]()
Поскольку молярный объём любого газа при н.у. составляет 22,4 л/моль, то формулу можно переписать в виде:
![]()
В данном случае количество вещества хлора будет равно:
![]()
Теперь следует найти количество вещества натрия, которое вступит в реакцию с указанным количеством хлора. Вспомним ещё раз, что по уравнению реакции всегда 2 моль Na реагируют без остатка с 1 моль Сl2. Составим пропорцию:
2 моль Na — 1 моль Сl2,
х моль Na — 0,4 моль Сl2.
Решая эту пропорцию, находим количество вещества натрия:
![]()
Эту величину можно было найти и по-другому. Количества веществ натрия и хлора относятся как их коэффициенты в уравнении реакции:
![]()
Отсюда количество вещества натрия составит:
n(Na) = 2n(Сl2) = 2 ∙ 0,4 = 0,8 моль.
Итак, количество вещества натрия, которое полностью провзаимодействует с 8,96 л хлора, равно 0,8 моль.
Ответ: n(Na) = 0,8 моль.
В кратком виде решение этой задачи можно записать так:

Пример 2. Вычислите количество вещества брома, необходимое для получения 17,76 г бромида железа(III).
Решение. Запишем уравнение химической реакции получения бромида железа(III) из железа и брома и прочитаем его:
2Fe + 3Вr2 = 2FeBr3
“При взаимодействии двух молей атомов железа с тремя молями молекул брома образуются два моля бромида железа(III)”.
Для нахождения количества вещества бромида железами) вспомним, что для любого вещества его количество, масса и молярная масса связаны соотношением:
![]()
Следовательно, количество вещества бромида железа(III) равно:
![]()
Из уравнения реакции видим, что количества веществ брома и бромида железа(III), связаны соотношением:
![]()
откуда n(Вr2) = 3n(FeBr3)/2 = 3 ∙ 0,06/2 = 0,09 моль.
Ответ: n(Вr2) = 0,09 моль.
В кратком виде решение этой задачи можно записать так:
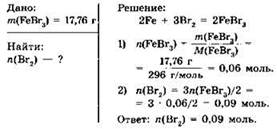
Вычисление массы
Подобные задачи совершенно аналогичны рассмотренным выше. Если решение предыдущих задач состояло из двух действий, то для нахождения массы вещества необходимо совершить третье действие. Покажем это на примерах.
Пример 3. Рассчитайте массу сульфата алюминия, который может быть получен при растворении в серной кислоте 5,4 г алюминия.
Решение. Как и ранее, сначала запишем уравнение химической реакции и прочитаем его:
2Аl + 3H2SO4 = Al2(SO4)3+ 3Н2
“При взаимодействии двух молей алюминия с тремя молями серной кислоты образуются один моль сульфата алюминия и три моля водорода”.
Для решения задачи наиболее важно, что всегда из 2 моль алюминия получается 1 моль сульфата алюминия.
Рассчитаем количество вещества алюминия:
![]()
Из уравнения реакции следует, что
![]()
т.е. n(Al2(SO4)3) = 1/2 n(Аl) = 0,1 моль.
Зная количество вещества, можно рассчитать и массу сульфата алюминия:
![]()
Ответ: m(Al2(SO4)3) = 34,2 г.
Пример 4. Какую массу диоксида марганца следует взять для получения 6,72 л хлора (н.у.)?
Решение. Запишем уравнение химической реакции между диоксидом марганца и соляной кислотой и прочитаем записанное уравнение:
![]()
“При взаимодействии 1 моль диоксида марганца с 4 моль хлороводорода образуются 1 моль хлорида марганца, 2 моль воды и 1 моль газообразного хлора”.
Для решения задачи необходима информация о том, что на 1 моль диоксида марганца всегда приходится 1 моль газообразного хлора, другими словами
n(МnO2) = n(Сl2).
Для нахождения количества вещества выделившегося хлора используем соотношение:
![]()
В данном случае количество вещества хлора будет равно:
![]()
Из уравнения химической реакции следует, что
n(МnO2) = n(Сl2) = 0,3 моль.
Зная количество вещества диоксида марганца, можно, используя величину молярной массы, рассчитать массу МnO2:
![]()
Ответ: m(МnO2) = 26,1 г.
Пример 5.
Для решения следует использовать закон объёмных отношений газов:
“Объёмы газов, участвующих в химической реакции, относятся как коэффициенты в уравнении реакции”.
Использование этого закона упрощает решение расчётных задач с участием газов. Действительно, в соответствии с законом объёмных отношений, объёмы кислорода и сероводорода соотносятся как:
![]()
Отсюда объём кислорода равен:
![]()
Ответ: H(SO2) = 15 л.
Пример 6. Какой объём воздуха (н.у.) необходим для полного сгорания 5 л метана?
Решение. Эта задача содержит один усложняющий элемент по сравнению с предыдущей. Сначала запишем уравнение реакции:
СН4 + 2O2 = СO2 + 2Н2O
На основании закона объёмных отношений газов можно записать, что объёмы кислорода и метана относятся как
![]()
Другими словами, объём кислорода вдвое превышает объём метана:
![]()
Но это ещё не окончательный ответ, т.к. в задаче требуется найти объём не кислорода, а воздуха. Вспомним, что кислород составляет примерно 1/5 часть воздуха. Следовательно объём воздуха, необходимого для сжигания метана, будет в 5 раз больше, чем объём кислорода:
![]()
Более точный ответ можно найти, если вспомнить, что воздух содержит 21% кислорода по объёму. Тогда объём воздуха будет равен:
![]()
Ответ: V(возд.) = 47,6 л (или 50 л, в зависимости от способа решения задачи).
Пример 8. Какой объём 15%-ного раствора серной кислоты плотностью 1,1 г/мл необходим для взаимодействия с 32 г оксида железа(III)?
Решение. Как и ранее, составим уравнение реакции и прочитаем его:
Fe2O3+ 3H2SO4 = Fe2(SO4)3+ 3H2O
“Один моль оксида железа взаимодействует с тре мя молями серной кислоты с образованием одного моля сульфата железа и трёх молей воды”.
В первом действии найдём количество вещества оксида железа:
![]()
Из уравнения реакции следует, что количество вещества серной кислоты (коэффициент 3) втрое больше количества вещества оксида железа(III) (коэффициент 1):
![]()
Следовательно, масса серной кислоты составит:
![]()
Мы нашли массу серной кислоты, но в задаче использован раствор её. Массу раствора можно найти из выражения для массовой доли растворённого вещества:
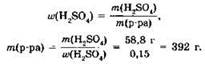
Зная массу раствора серной кислоты и его плотность, можно рассчитать объём раствора:
![]()
Ответ: V(p-pa H2SO4) = 356,4 мл.
В кратком виде решение этой задачи можно записать так:

В заключение этого раздела приведём ещё раз формулы, необходимые при решении задач.
Обозначения:
n(Х) — количество вещества X,
m(Х) — масса вещества X,
М(Х) — молярная масса вещества X,
V(X) — объём газа X,
Vm — молярный объём газа,
ω(X) — массовая доля вещества X,
m(p-pa X) — масса раствора вещества X.
Расчётные формулы:
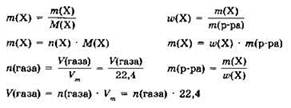
Задания
Часть 2
Дайте полный развёрнутый ответ на задание части 2.
1. К 200 г раствора серной кислоты с массовой долей 12,25% прилили избыток раствора нитрата бария. Определите массу выпавшего осадка.
2. Рассчитайте массу осадка, который выпадет при взаимодействии избытка карбоната калия с 17,4 г раствора нитрата бария с массовой долей последнего 15%.
3. В избытке соляной кислоты растворили 1,506 г руды, содержащей 77% карбоната железа(II). Определите объём углекислого газа, выделившегося при этом.
4. При взаимодействии 24 г руды, содержащей карбонат железа(II), с избытком соляной кислоты выделилось 4,48 л углекислого газа. Определите массовую долю карбоната железа в руде.
5. При взаимодействии избытка раствора карбоната калия с 10%-ным раствором нитрата бария выпало 3,94 г осадка. Определите массу взятого для опыта раствора нитрата бария.
6. При растворении в избытке разбавленной серной кислоты цинка, содержащего 4,5% нерастворимых примесей, выделилось 2,24 л (н.у.) водорода. Определите массу растворённого металла.
7. При растворении 10 г технического цинка в избытке разбавленной соляной кислоты выделилось 3,1 л (н.у.) водорода. Определите массовую долю примесей в этом образце цинка.
8. Рассчитайте массу осадка, который выпадет при сливании 500 г 2%-ного раствора иодида калия с избытком раствора нитрата свинца(II).
9. При растворении 160 г известняка в избытке азотной кислоты выделилось 34,27 л (н.у.) углекислого газа. Определите массовую долю примесей в данном образце известняка.
10. При взаимодействии 150 г раствора нитрата свинца(II) с небольшим избытком раствора иодида калия выпало 10,45 г осадка. Рассчитайте массовую долю нитрата свинца(II) в исходном растворе.
11. Какая масса соли образуется при взаимодействии 0,5 моль гидроксида кальция с избытком серной кислоты?
12. Какая масса серной кислоты потребуется для полного растворения 36 г магния?
13. Какой объём газа выделится при взаимодействии 128 г цинка с избытком раствора соляной кислоты?
14. Какой объём газа выделится при взаимодействии 25 г карбоната кальция с избытком раствора азотной кислоты?
15. Какая масса оксида меди(II) прореагировала с серной кислотой, если в результате реакции образовалась соль массой 20 г?
16. Какая масса оксида магния прореагировала с избытком соляной кислоты, если в результате реакции образовалась соль массой 47,5 г?
17. Какое количество вещества сульфата бария образуется при реакции 52 г хлорида бария с избытком серной кислоты?
18. Какое количество вещества хлорида серебра образуется при реакции 17 г нитрата серебра с избытком соляной кислоты?
19. Вычислите массу сульфата калия, образовавшегося при добавлении 65,3 г 15%-ного раствора серной кислоты к избытку раствора гидроксида калия.
20. Вычислите массу 20%-ного раствора азотной кислоты, который необходим для нейтрализации раствора, содержащего 80 г гидроксида натрия.
21. Вычислите массу осадка, образовавшегося при сливании 100 г 15%-ного раствора сульфата калия и 80 г 5%-ного раствора нитрата бария.