Химия - Новый полный справочник для подготовки к ОГЭ - 2018 год
Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов - Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Физический смысл порядкового номера химического элемента
Изменение свойств элементов в главных подгруппах
В состав подгрупп входят химические элементы со сходными свойствами. Если число электронов на внешнем уровне одинаково для всех элементов одной подгруппы (оно равно номеру группы), то другие свойства элементов закономерно изменяются в подгруппе с увеличением зарядов ядер атомов. Так, сверху вниз возрастает число заполненных электронных слоёв, следовательно, возрастают атомные радиусы элементов. В силу этого возрастает лёгкость отдачи внешних электронов, уменьшается электроотрицательность элементов, усиливаются металлические свойства и, напротив, ослабевают неметаллические свойства простых веществ, образованных этими элементами. Соответственно, кислотные свойства оксидов и гидроксидов сверху вниз по подгруппе уменьшаются, а основные — усиливаются.
Так, для элементов IVA группы:
![]()
с увеличением заряда ядра от 6 до 82:
— возрастает атомный радиус от 0,77Å для углерода до 1,75Å для свинца;
— уменьшается энергия, необходимая для отрыва электрона из атома (энергия ионизации), от значения 11,3 эВ для углерода до 7,4 эВ для свинца;
— уменьшается электроотрицательность элементов от 2,5 для углерода до 1,5 для свинца.
Все эти данные свидетельствуют об ослаблении неметаллического характера элементов и усилении металлического характера. Действительно, углерод и кремний относятся к типичным неметаллам, в то время как простые вещества олово и свинец — металлы.
В ряду высших оксидов
![]()
первые два проявляют исключительно кислотные свойства, оксид германия — амфотерный, с преобладанием кислотных свойств, оксид олова — амфотерный, с преобладанием основных свойств, оксид свинца — преимущественно проявляет основные свойства. Следовательно, происходит закономерное ослабление кислотных свойств оксидов (и гидроксидов) и усиление основных.
Свойства элементов главной и побочной подгрупп существенно различаются. В то же время, благодаря Периодической системе, мы находим много общего в свойствах всех элементов, образующих данную группу.
Так, в VII группе имеются два элемента — хлор (VIIA, группа) и марганец (VIIB группа). Хлор образует простое вещество — неметалл, газообразный при обычных условиях, очень ядовитый. Марганец — типичный металл со всеми свойствами металлов (твёрдый, пластичный, электропроводный). Что же объединяет эти несхожие элементы? Почему они находятся в одной группе Периодической системы? Всё дело в том, что и атомы хлора, и атомы марганца содержат по 7 валентных электронов:
![]()
Поэтому высшая степень окисления для этих элементов одна и та же, а именно +7.
Хлор и марганец образуют высшие оксиды одного состава: Сl2O7 и Мn2О7. Оба эти оксида кислотные, энергично взаимодействуют с водой с образованием кислот одного и того же состава:
Сl2O7 + Н2O = 2НСlO4 — хлорная кислота,
Мn2O7 + Н2O = 2НМnO4 — марганцевая кислота
Оба оксида (и отвечающие им кислоты) — очень неустойчивы и являются сильнейшими окислителями.
И хлорная, и марганцевая кислоты относятся к наиболее сильным кислотам. При нейтрализации кислот получаются однотипные соли — перхлораты и перманганаты, например КСlO4 и КМnO4. При небольшом нагревании обе соли легко разлагаются с выделением кислорода. Всё это и позволяет рассматривать элементы хлор и марганец в одной группе Периодической системы элементов Д.И. Менделеева.
Изменение свойств элементов по периоду
Рассмотрим свойства элементов второго периода:
![]()
Второй период, как и все остальные периоды, начинается с s-элемента, в данном случае с лития. Электронная конфигурация внешнего электронного уровня атома лития 2s1. Заканчивается второй период, как и все остальные периоды, p-элементом, в данном случае инертным газом неоном, внешняя электронная конфигурация которого 2s22p6. С увеличением зарядов ядер атомов по периоду происходит последовательное увеличение числа электронов на внешнем уровне — от 1 в атоме лития до 8 в атоме неона. Это приводит к уменьшению атомного радиуса от 1,59Å в случае лития до 0,35Å в случае неона. Следствием уменьшения атомных радиусов является ослабление металлических свойств простых веществ, образованных элементами второго периода, и усиление неметаллических. С уменьшением атомных радиусов увеличивается электроотрицательность элементов от 1,0 у лития до 4,1 у фтора. Всё это обуславливает ослабление основного характера оксидов и гидроксидов и усиление кислотных свойств оксидов и гидроксидов по периоду слева направо.
Так, первые два химических элемента второго периода — литий и бериллий — относятся к металлам, остальные элементы — к неметаллам. Оксид лития Li2O обладает сильными основными свойствами, ему отвечает гидроксид LiOH — сильное основание, щёлочь. Следующий элемент — бериллий — образует оксид ВеО и гидроксид Ве(ОН)2 — с амфотерными свойствами. Таким образом, основность оксида и гидроксида значительно уменьшается при переходе от Li к Be. Последующие элементы — бор, углерод и азот — образуют оксиды и гидроксиды кислотного характера, причём в ряду оксидов В2O3 — СO2 — N2O5или гидроксидов Н3ВO3 — Н2СO3 — HNO3 кислотность существенно возрастает. Если борная кислота относится к наиболее слабым кислотам, то азотная кислота — одна из сильнейших неорганических кислот.
В третьем периоде характер изменения свойств элементов и их соединений в принципе такой же, поскольку аналогичны электронные конфигурации элементов третьего и второго периодов. Начинается третий период s-элементом — щелочным металлом натрием, образующим оксид Na2O и гидроксид NaOH с сильными основными свойствами. Основность оксида и гидроксида магния (MgO и Mg(OH)2) существенно ниже, чем у соединений натрия — это связано с уменьшением атомного радиуса, увеличением электроотрицательности и ослаблением металлических свойств элементов по периоду. Металлические свойства алюминия — первого p-элемента третьего периода — ещё более ослаблены по сравнению с магнием. Поэтому алюминий образует оксид Аl2O3 И гидроксид Аl(ОН)3, обладающие амфотерными свойствами. Следовательно, основный характер оксида и гидроксида алюминия ещё менее выражен, чем у соединений магния. Более того, сам факт амфотерности указывает на проявление слабых кислотных свойств у соединений алюминия. Кислотный характер оксидов и гидроксидов ещё более усиливается при переходе к следующим элементам третьего периода. Кремний, фосфор, сера и хлор образуют оксиды и гидроксиды с ярко выраженными кислотными свойствами, причём от кремния к хлору кислотность соединений существенно усиливается. Если кремниевая кислота H4SiO4 относится к слабым кислотам, то фосфорная Н3РO4 — к кислотам средней силы, а серная H2SO4 и хлорная НСlO4 — к сильным кислотам. Завершается третий период инертным газом аргоном.
Рассмотренные тенденции в изменении свойств элементов и их соединений по периодам Периодической системы химических элементов сохраняются и в больших периодах, например в четвёртом. Однако в больших периодах есть и особенности в изменении свойств элементов. Так, четвёртый период начинается s-элементами калием и кальцием, атомы которых имеют на внешнем энергетическом уровне соответственно 1 и 2 электрона:
![]()
Если в малых периодах после s-элементов следуют p-элементы, то в больших периодах между s- и р-элементами вклинивается семейство d-элементов. В четвёртом периоде за элементом кальцием следуют 10 d-элементов, в атомах которых заполняется предвнешний 3d-подуровень:
![]()
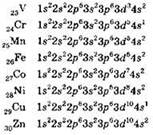
После заполнения 3d-подуровня происходит заполнение электронами 4р-подуровня. Электронные конфигурации p-элементов четвёртого периода таковы:
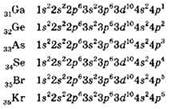
Поскольку в атомах переходных элементов заполняется не внешний, а предвнешний подуровень (в то время как число электронов на внешнем уровне остаётся практически одинаковым), то свойства элементов при переходе от скандия к цинку меняются более плавно. Медленнее, чем во втором и третьем периодах, уменьшаются атомные радиусы, уменьшаются металлические свойства, возрастает электроотрицательность. Следует заметить, что если переходный элемент образует производные в нескольких степенях окисления, то с ростом степени окисления происходит закономерное уменьшение основных свойств оксидов и гидроксидов и усиление кислотных свойств.
Так, марганец образует оксиды МnО, Мn2O3, МnO2, Мn2O7. В этом ряду основность оксидов заметно уменьшается. Оксиду марганца(II) отвечает основание Мn(ОН)2, являющееся основанием средней силы, способным вытеснять, например, аммиак из его солей (так ведут себя гидроксиды щелочных и щелочноземельных металлов). Основность оксидов марганца(III) и (IV) заметно ниже. Оксид же марганца(VII) основных свойств практически не проявляет, он относится к кислотным оксидам, образующим с водой кислоту, в данном случае — марганцевую кислоту НМnO4. Таким образом, оксид марганца(II) МnО проявляет основные свойства, оксиды Мn2O3 и МnO2 — амфотерные свойства, а оксид Мn2O7 — кислотные. Таков же характер изменения кислотно-основных свойств оксидов и гидроксидов в зависимости от степени окисления и для остальных переходных элементов.
В заключение раздела укажем, что химические элементы, расположенные в диагональном направлении Периодической системы, также иногда могут проявлять близость многих физических и химических свойств. Это явление носит название “диагонального сходства”. Так, химические свойства лития и его соединений иногда оказываются гораздо ближе к свойствам магния, чем к свойствам остальных щелочных металлов. Аналогично, свойства бериллия гораздо ближе к свойствам алюминия, чем к свойствам щелочноземельных металлов, а свойства бора — ближе к свойствам кремния:
![]()
Диагональное сходство можно объяснить, если принять во внимание характер изменения атомных радиусов по группам и периодам: уменьшение радиусов в периодах (слева направо) приблизительно компенсируется увеличением радиусов в группах (сверху вниз). Тем самым, оказываются весьма близки атомные радиусы лития и магния, бериллия и алюминия и др.
Задания
Часть 1
К каждому из заданий части 1 даны 4 варианта ответа, из которых только один правильный.
1. Порядковый номер химического элемента в Периодической системе Д.И. Менделеева соответствует:
1) числу электронов в атоме
2) значению высшей валентности элемента по кислороду
3) значению валентности в водородном соединении
4) числу электронных слоев в атоме
2. Номер группы в Периодической системе химических элементов Д.И. Менделеева соответствует
1) числу электронов в атоме
2) значению высшей валентности элемента по кислороду
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) числу электронных слоев в атоме
3. Номер периода в Периодической системе химических элементов Д.И. Менделеева равен числу
1) электронов в атоме
2) электронов во внешнем слое атомов
3) недостающих электронов до завершения электронного слоя
4) заполняемых электронных слоев в атоме
4. В периоде с увеличением атомного номера химического элемента происходит
1) уменьшение заряда ядра атома
2) усиление металлических свойств
3) уменьшение атомного радиуса
4) уменьшение числа валентных электронов
5. Радиус атомов увеличивается в ряду элементов
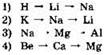
6. В главных подгруппах Периодической системы с увеличением заряда ядра атомов происходит
1) усиление неметаллических свойств элементов
2) уменьшение числа протонов в ядре
3) увеличение радиуса атомов
4) увеличение электроотрицательности
7. В главных подгруппах Периодической системы с увеличением заряда ядра атомов химических элементов
1) усиливаются неметаллические свойства
2) уменьшаются металлические свойства
3) изменяется валентность в водородных соединениях
4) остаётся постоянной высшая валентность
8. Неметаллические свойства усиливаются в ряду
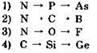
9. В порядке увеличения числа электронов на внешнем уровне элементы расположены в ряду:
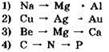
10. Четыре электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) С, Si, Sn.
2) О, Cl, I
3) N, С, S.
4) Mg, Be, Ca
11. Химический элемент, схема строения электронных оболочек атома которого 2ē, 8ē, 7ē, образует высший оксид состава
1) Э2O7
2) Э2O
3) ЭO2
4) ЭO3
12. Атомы химических элементов бора и алюминия имеют одинаковое число
1) заполненных электронных слоёв
2) протонов
3) электронов во внешнем электронном слое
4) нейтронов
13. Изменение свойств от металлических к неметаллическим происходит в ряду
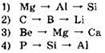
14. Порядковый номер химического элемента в Периодической системе показывает
1) количество энергетических уровней
2) число валентных электронов
3) число протонов в ядре атома
4) атомную массу
15. Номер периода в Периодической системе показывает
1) количество заполняемых энергетических уровней
2) заряд атомного ядра
3) число валентных электронов
4) атомную массу элемента
16. Наименьший радиус атома имеет
1) С
2) Be
3) В
4) N
17. Одинаковую электронную конфигурацию имеют частицы Na+ и
1) S4+
2) Сl-
3) Са
4) Р5+
18. Наиболее сильные металлические свойства проявляет
1) стронций
2) магний
3) кальций
4) бериллий
19. Наиболее сильные неметаллические свойства проявляет
1) хлор
2) фосфор
3) кремний
4) сера
20. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
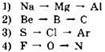
21. В порядке возрастания атомного радиуса химические элементы расположены в ряду:
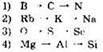
22. Атому химического элемента, образующего высший оксид состава R207, соответствует электронная конфигурация
1) 1s22s22p63s1
2) 1s22s22p63s23p5
3) 1s22s22p63s23p64s1
4) 1s22s22p63s23p64s23d7
23. Химический элемент образует высший оксид состава RO3. Какую электронную конфигурацию имеет внешний энергетический уровень его атома?
1) ns2np4
2) ns2np3
3) ns2np2
4) ns2np6
24. Наибольшей восстановительной активностью обладает
1) литий
2) бериллий
3) азот
4) сера
25. Наиболее энергично присоединяет электроны в химических реакциях атом
1) серы .
2) хлора
3) селена.
4) брома
26. В ряду химических элементов: Na — Mg — Al — Si
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
При выполнении заданий выберите правильные ответы.
27. В ряду химических элементов Na — Mg — Al:
1) уменьшается заряд ядер атомов
2) увеличивается число электронов во внешнем электронном слое
3) уменьшается электроотрицательность
4) уменьшается радиус атомов
5) усиливаются металлические свойства
Ответ: ____ .
28. В ряду химических элементов Li — Be — В
1) увеличивается заряд ядер атомов
2) возрастают кислотные свойства образуемых гидроксидов
3) увеличивается число электронных уровней
4) уменьшается электроотрицательность
5) возрастает атомный радиус
Ответ: ____ .
29. В ряду химических элементов Be — Mg — Са
1) увеличивается атомный радиус
2) возрастает высшая степень окисления
3) увеличивается значение электроотрицательности
4) увеличиваются основные свойства образуемых гидроксидов
5) уменьшается число электронов на внешнем уровне
Ответ: ____ .
30. В ряду химических элементов F — Сl — Вr
1) уменьшается электроотрицательность
2) увеличивается сила образуемых кислородсодержащих кислот
3) увеличивается сила образуемых бескислородных кислот
4) уменьшается радиус атомов
5) увеличивается значение высшей степени окисления
Ответ: ____ .
31. В ряду химических элементов Na — К — Rb
1) возрастает высшая степень окисления
2) увеличивается атомный радиус
3) увеличивается значение электроотрицательности
4) увеличиваются основные свойства образуемых гидроксидов
5) уменьшается число электронов на внешнем уровне
Ответ: ____ .
32. В ряду химических элементов Аl — Si — Р
1) увеличивается заряд ядер атомов
2) возрастают кислотные свойства образуемых гидроксидов
3) увеличивается число электронных уровней в атоме
4) уменьшается электроотрицательность
5) возрастает атомный радиус
Ответ: ____ .
33. В ряду химических элементов О — S — Se
1) уменьшается радиус атомов
2) увеличивается значение высшей степени окисления
3) увеличивается сила кислот Н2Э
4) уменьшается электроотрицательность
5) увеличивается число внешних электронов
Ответ: ____ .
34. В ряду химических элементов N — Р — As
1) уменьшается электроотрицательность
2) увеличивается сила образуемых кислородсодержащих кислот
3) уменьшаются основные свойства соединений Н3Э
4) уменьшается радиус атомов
5) увеличивается значение высшей степени окисления
Ответ: ____ .
35. В ряду химических элементов Si — Р — S
1) уменьшается атомный радиус
2) уменьшается электроотрицательность
3) возрастает число валентных электронов
4) увеличивается число энергетических уровней
5) уменьшаются кислотные свойства образуемых гидроксидов
Ответ: ____ .
36. В ряду химических элементов Sr — Ва — На
1) увеличивается значение электроотрицательности
2) уменьшается число электронов на внешнем уровне
3) увеличивается атомный радиус
4) увеличиваются основные свойства образуемых гидроксидов
5) возрастает высшая степень окисления
Ответ: ____ .
37. В ряду химических элементов В — С — N
1) увеличивается заряд ядер атомов
2) возрастают кислотные свойства образуемых гидроксидов
3) увеличивается число электронных уровней
4) уменьшается электроотрицательность
5) возрастает атомный радиус
Ответ: ____ .