Химия - Новый полный справочник для подготовки к ОГЭ - 2018 год
Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая
Под химической связью понимают взаимодействие, приводящее к образованию физически устойчивой двухатомной системы. Термин “физически устойчивая система” означает, что при образовании химической связи энергия выделяется, что схематически может быть изображено в виде диаграммы, изображённой на рисунке 8.
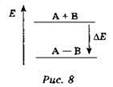
Из диаграммы видно, что образование химической связи А—В при взаимодействии двух атомов А и В сопровождается выделением энергии ΔЕ. Эту энергию называют энергией связи: чем больше энергия связи, тем прочнее молекула.
Химическая связь образуется за счёт валентных электронов. Валентными являются s- и р-электроны внешнего уровня (для непереходных элементов), а также d-электроны предвнешнего уровня (для переходных элементов).
Различают три основных типа химических связей: ковалентную, ионную и металлическую.
Ковалентная связь
Ковалентная связь осуществляется за счёт образования общих электронных пар. Ковалентная неполярная связь образуется между атомами одного и того же химического элемента, например в молекулах Н2, O2, Сl2, Na2*. Ковалентная полярная связь образуется между атомами (обычно неметаллов), отличающимися по электроотрицательности, например в молекулах НСl, Н2O, NH3, а также АlСl3, Tid4 и др.
Существуют два механизма образования ковалентной связи — обменный механизм (или механизм обобществления электронов) и донорно-акцепторный механизм.
В соответствии с первым механизмом ковалентная связь образуется при спаривании электронов, принадлежавших разным атомам. Так, при взаимодействии двух атомов водорода (электронная конфигурация 1s1) происходит образование общей электронной пары:
![]()
Аналогично, образование общей электронной пары происходит и при взаимодействии атомов водорода и хлора (конфигурация 3s23p5):
![]()
В обоих случаях при сближении атомов происходит частичное перекрывание их электронных облаков, при этом в области между ядрами увеличивается плотность электронного заряда, что и приводит к образованию химической связи.
В соответствии с донорно-акцепторным механизмом образования ковалентной связи, у одного атома (донора) должна быть неподелённая электронная пара, которая взаимодействует с вакантной орбиталью другого атома (акцептора):
![]()
И в этом случае химическая связь обусловлена появлением общей электронной пары, которая до взаимодействия принадлежала одному из атомов.
Нельзя говорить об особых “донорно-акцепторных связях”: и в первом случае, и во втором случае образуется ковалентная связь. Механизмы образования ковалентной связи различны, но природа связи одинакова во всех этих случаях.
Донорно-акцепторный механизм образования ковалентной связи реализуется во многих неорганических соединениях. Одна из связей образована по донорно-акцепторному механизму в ионе аммония NH4+, ионе гидроксония Н3O+, молекулах озона O3 и азотной кислоты.
Так, молекула аммиака взаимодействует с ионом водорода (протоном) с образованием иона аммония:
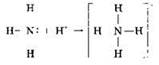
Одна из связей в ионе аммония образована по донорно-акцепторному механизму, но она ничем не отличается от остальных химических связей в этом ионе — ни длиной, ни прочностью (энергией).
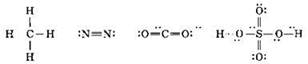
Если между двумя атомами образовалась одна ковалентная связь (одна общая электронная пара), то она называется одинарной. Между двумя атомами могут возникать и кратные связи — двойные (две общие электронные пары) и тройные (три общие электронные пары). В структурных формулах одинарные связи изображаются одним валентным штрихом, двойные связи — двумя валентными штрихами, тройные — тремя. Ниже приведены структурные формулы некоторых молекул (с изображением неподелённых электронных пар, оставшихся на атомах после образования химических связей):
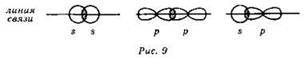
Среди ковалентных связей принято выделять, в соответствии с симметрией электронного облака, σ- и π-связи. σ-Связи образуются при перекрывании электронных облаков вдоль линии связи (рис. 9):
π-Связи образуются при боковом перекрывании р-электронных облаков над и под линией связи (рис. 10):
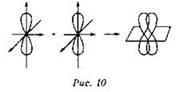
Если между двумя атомами действует одинарная связь, то она относится всегда к σ-связям. В случае кратных связей между двумя атомами одна из них всегда σ-связь, остальные — π-связи. Так, в приведённых выше формулах π-связи имеются в молекулах азота (1σ и 2π), углекислого газа (2σ и 2π) и серной кислоты (6σ и 2π). В молекуле же метана все атомы связаны только σ-связями (4σ).
Основными характеристиками ковалентной связи являются длина и энергия. Под длиной связи понимают соответствующее межъядерное расстояние. Химическая связь тем прочнее, чем меньше её длина. Так, в ряду однотипных соединений HF — НСl — НВr — HI происходит увеличение длины связи, вызванное увеличением размера атомов галогенов сверху вниз по подгруппе. Соответственно, в этом же ряду происходит и уменьшение прочности химической связи, уменьшение её энергии. Под энергией связи понимают энергию, которая выделяется при образовании химической связи. Энергию связи выражают обычно в кДж/моль. Энергия связи по модулю равна энергии диссоциации (т.е. разрыва) связи. Энергия связи также зависит от кратности — с увеличением кратности длина связи уменьшается, а прочность её возрастает. Основными свойствами ковалентной связи являются также её насыщаемость и направленность в пространстве.
Особо рассмотрим образование химических связей в молекуле азотной кислоты HNO3.
Атом азота максимально может образовать четыре ковалентные связи — три по механизму спаривания электронов и одну по донорно-акцепторному механизму, что вытекает из его электронного строения (рис. 11).
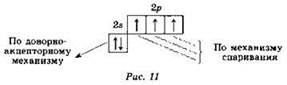
Пять ковалентных связей атом азота, как известно, образовать не может из-за отсутствия вакантных (свободных) атомных орбиталей во втором энергетическом уровне.
Структурную формулу молекулы азотной кислоты с учётом четырёхковалентности азота можно изобразить двумя способами (рис. 12).
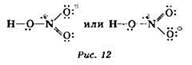
Наличие формальных зарядов “+” и “-” связано с донорно-акцепторным Механизмом образования одной из связей — электронная плотность от атома азота (донора) поступает на орбиталь атома кислорода (акцептора).
Если бы верны были изображённые нами формулы, то в молекуле азотной кислоты должны быть разные концевые связи NO — одна более короткая (двойная), другая — более длинная (одинарная). Однако экспериментальное исследование позволило установить равноценность этих двух концевых NO-связей. Их длина оказалась меньше, чем у одинарных связей, и больше, чем у двойных. Эту ситуацию можно объяснить, если предположить, что истинное строение молекулы азотной кислоты является промежуточным между приведёнными выше двумя так называемыми граничными (или предельными) структурами. Это возможно, если предположить, что в этой молекуле π-связь, в отличие от о-связи, делокализована (как бы “размазана”) по двум направлениям (более подробно с этой ситуацией вы будете знакомиться в старших классах при профильном изучении химии). В соответствии с этим предположением структурную формулу азотной кислоты изображают так (рис. 13):
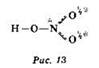
Делокализована не только π-связь, но и формальный заряд на атомах кислорода. Говорят, что в молекуле азотной кислоты кратность концевых связей NO равна 1,5 (1σ и 0,5π). Подобные “полуторные связи” известны во многих и неорганических, и органических молекулах.
Ионная связь
Химическая связь, осуществляемая за счёт электростатического взаимодействия разноимённо заряженных ионов, называется ионной.
Ионом называют заряженную частицу, которая образуется при присоединении электрона к атому или молекуле или при отдаче электрона атомом или молекулой.
Соединения с ионной связью образуются при взаимодействии атомов элементов, резко отличающихся по электроотрицательности, например — при взаимодействии щелочных или щелочноземельных металлов с кислородом или галогенами.
Рассмотрим, например, взаимодействие атомов натрия и хлора. Электронные конфигурации этих атомов таковы:
![]()
Видно, что это атомы с незавершёнными внешними электронными оболочками. Атому натрия до получения завершённого внешнего уровня легче отдать 1 электрон, чем принять недостающие 7. Атому хлора, наоборот, легче принять недостающий 8-й электрон, чем отдать 7 электронов. Это представлено схемами:
![]()
И в одном, и в другом случае получаются ионы с полностью завершённым 8-электронным внешним уровнем (подчёркнуто в формуле). Подобные частицы с полностью завершённым внешним уровнем обладают повышенной устойчивостью, это и является движущей силой образования ионных соединений.
Образовавшиеся ионы Na+ и Сl- взаимодействуют и объединяются в ионную молекулу:
![]()
Ионная связь присутствует в таких соединениях, как NaCl, KI, CsBr, CaO, BaF2 и др.
Ионные молекулы существуют только в газовой фазе при высоких температурах. В твёрдом (кристаллическом состоянии) каждый положительно заряженный ион взаимодействует не с одним отрицательно заряженным ионом, а с множеством таких ионов. Это является следствием ненаправленности и ненасыщаемости ионной связи. В результате такого взаимодействия образуются ионные кристаллы, характеризующиеся регулярным, упорядоченным расположением ионов в пространстве (в узлах так называемой кристаллической решётки). Так, в реальном кристалле поваренной соли каждый ион натрия окружён шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами натрия.
Отметим, что в реальности 100%-ной ионной связи не существует. Даже в таком соединении, как CsF, степень ионности связи не превышает 92%, а в кристаллическом NaCl ещё меньше — всего 85%. Поэтому правильнее говорить о веществах с преимущественно ионным типом связи.
Металлическая связь
Металлическая связь — разновидность ненаправленной ковалентной связи. Она осуществляется между атомами с небольшим числом валентных электронов, слабо удерживаемых ядром, и большим числом вакантных валентных орбиталей. Металлическая связь существует в твёрдых металлах и их сплавах.
В атомах металлов на внешнем уровне находится небольшое число электронов (один-два, реже — три). В то же время имеется относительно большое число свободных орбиталей на внешнем уровне. Так, у атома лития на 1 внешний электрон приходится 3 вакантных орбитали, в атоме натрия — на 1 внешний электрон приходится 8 вакантных орбиталей. Валентные электроны слабо удерживаются ядром и способны свободно перемещаться в пределах всех свободных орбиталей. В результате при образовании кристаллической решётки валентные орбитали соседних атомов перекрываются и электроны свободно перемещаются с одной орбитали на другую в пределах всего кристалла, осуществляя тем самым химическую связь между всеми атомами металла. Так и образуется металлическая связь. Таким образом, твёрдый металл представляет собой “каркас” из атомов и положительных ионов, находящихся в узлах кристаллической решётки и погруженных в “море” подвижных электронов. Как и другие виды химической связи, металлическая связь также имеет электростатическую природу.
С особенностями металлической связи связаны такие свойства металлов, как высокие электро- и теплопроводность, характерный металлический блеск, ковкость и пластичность.
Основное отличие металлической связи от ковалентной связано с ненаправленностью металлической связи и её меньшей прочностью.
Задания
Часть 1
К каждому из заданий части 1 даны 4 варианта ответа, из которых только один правильный.
1. Какое из указанных веществ имеет ионную химическую связь?
1) оксид кремния(IV)
2) бромид калия
3) магний
4) сероводород
2. Ионная химическая связь реализуется в
1) хлороводороде
2) гидроксиде натрия
3) оксиде углерода(II)
4) оксиде углерода(IV)
3. Ионная химическая связь реализуется в
1) кристаллической сере
2) твёрдом иоде
3) иодиде кальция
4) оксиде фосфора(V)
4. Ковалентная полярная связь присутствует в молекуле
1) кислорода
2) ромбической серы
3) воды
4) водорода
5. Ковалентная полярная связь имеется в молекуле
1) серной кислоты.
2) пластической серы
3) хлора .
4) сульфида рубидия
6. Только ковалентные неполярные связи реализуются в
1) молекуле воды
2) кристалле SiO2
3) кристалле кремния
4) молекуле пероксида водорода
7. Ковалентная неполярная связь реализуется в
1) молекуле оксида углерода(IV)
2) молекуле S8
3) кристаллическом льду
4) молекуле NH3
8. Химическая связь в кристалле хлорида натрия
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
9. Химическая связь в молекуле углекислого газа
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
10. Химическая связь в молекуле водорода
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
11. Химическая связь в кристалле оксида кальция
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
12. Химические связи в молекуле этанола
1) ковалентные
2) водородные
3) металлические
4) ионные
13. Ковалентная неполярная связь реализуется в
1) молекуле оксида серы(IV)
2) фуллерене С60
3) кристаллическом диоксиде углерода
4) молекуле СН4
14. Ковалентная полярная связь реализуется в
1) фуллерене С60
2) молекуле CS2
3) металлической бронзе
4) молекуле N2
*Да-да, существуют и молекулы Na2. В кристаллическом натрии реализуется металлическая кристаллическая решётка и металлическая связь. Но в газовой фазе возможно взаимодействие отдельных атомов натрия друг с другом с образованием двухатомных молекул. Химическая связь в такой молекуле ковалентная неполярная.