Химия - Универсальный справочник школьника подготовка к ЕГЭ
Сера и ее соединения - Особенности свойств водорода, хлора, брома, йода, кислорода, серы, азота, фосфора, углерода, кремния и их соединений - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Строение и свойства атомов серы
Атомы серы (S), как и атомы кислорода и всех остальных элементов главной подгруппы VI группы, содержат на внешнем энергетическом уровне 6 электронов, из которых два электрона неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют выраженные восстановительные свойства, образуя соединения со степенями окисления +2, +4, +6. По отношению к менее отрицательным элементам (водород, металлы) сера проявляет окислительные свойства и приобретает степень окисления -2.

Сера — простое вещество
Для серы, как и для кислорода, характерна аллотропия. Известно много модификаций серы с циклическим или линейным строением молекул различного состава.
- ЗАПОМНИ
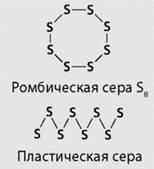
Наиболее устойчива модификация, известная под названием ромбической серы, состоящая из молекул S8. Ее кристаллы имеют вид октаэдров со срезанными углами. Они окрашены в лимонно-желтый цвет и полупрозрачны, температура плавления 112,8 °С. В эту модификацию при комнатной температуре превращаются все другие модификации. При кристаллизации из расплава сначала получается моноклинная сера (игольчатые кристаллы, температура плавления 119,3 °С), которая затем переходит в ромбическую. При нагревании кусочков серы в пробирке она плавится, превращаясь в жидкость желтого цвета. При температуре около 160 °С жидкая сера начинает темнеть, становится густой и вязкой, не выливается из пробирки, при дальнейшем нагревании превращается в легкоподвижную жидкость, но сохраняет прежний темно-коричневый цвет. Если ее вылить в холодную воду, она застывает в виде прозрачной резинообразной массы. Это пластическая сера. Ее можно получить и в виде нитей. Через несколько дней она также превращается в ромбическую серу.
Сера не растворяется в воде. Кристаллы серы в воде тонут, а вот порошок плавает на поверхности воды, т. к. мелкие кристаллики серы водой не смачиваются и поддерживаются на плаву мелкими пузырьками воздуха. Это процесс флотации. Сера малорастворима в этиловом спирте и диэтиловом эфире, хорошо растворяется в сероуглероде.
Химические свойства серы
При обычных условиях сера реагирует со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром, например:
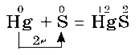
Эта реакция лежит в основе удаления и обезвреживания разлитой ртути, например, из разбитого термометра. Видимые капли ртути можно собрать на лист бумаги или на медную пластику. Ту ртуть, которая попала в щели, нужно засыпать порошком серы. Такой процесс называется демеркуризацией.
При нагревании сера реагирует и с другими металлами (Zn, Al, Fe), и только золото не взаимодействует с ней ни при каких условиях.
Окислительные свойства сера проявляет и с водородом, с которым реагирует при нагревании:
H2 + S = H2S
Из неметаллов с серой не реагирует только азот, иод и благородные газы.
Сера горит синеватым пламенем, образуя оксид серы (IV):
S + O2 = SO2
Это соединение широко известно под названием сернистый газ.
Сера в природе
В природе сера встречается в трех формах: самородная, сульфидная и сульфатная (табл. 8).
Таблица 8
Сера в природе
|
Самородная сера |
Сульфидная сера |
Сульфатная сера |
|
Ромбическая сера S8 |
Сероводород — H2S |
Глауберова соль Na2SO4 · 10H2O |
|
Цинковая обманка — ZnS |
Гипс CaSO4 · 2H2O |
|
|
Киноварь — HgS |
||
|
Свинцовый блеск — PbS |
||
|
Пирит или колчедан — FeS2 |
Биологическое значение серы
Сера — жизненно важный химический элемент. Она входит в состав белков — одних из основных химических компонентов клеток всех живых организмов. Особенно много серы в белках волос, рогов, шерсти. Кроме этого, сера является составной частью биологически активных веществ организма: витаминов и гормонов (например, инсулина).
Сера участвует в окислительно-восстановительных процессах организма. При недостатке серы в организме наблюдается хрупкость и ломкость костей и выпадение волос.
Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца.
Применение серы
Сера используется в производстве спичек и бумаги, резины и красок, взрывчатых веществ и лекарств, пластмассы и косметических препаратов. В сельском хозяйстве ее используют для борьбы с вредителями растений.
Однако основной потребитель серы — химическая промышленность. Около половины добываемой в мире серы идет на производство серной кислоты.
Соединения серы
Оксид серы (IV) SO3, который часто называют также сернистым газом, образуется при горении серы, полном сгорании сероводорода и обжиге сульфидов. Это бесцветный газ с характерным резким запахом. Он проявляет типичные свойства кислотных оксидов и хорошо растворяется в воде, образуя слабую сернистую кислоту. Она неустойчива и разлагается на исходные вещества:
![]()
Соли сернистой кислоты, как двухосновной, могут быть средними — сульфитами, например сульфит натрия Na2SO3, и кислыми — гидросульфитами, например гидросульфит натрия NaHSO3. Гидросульфит и сульфит натрия, как и сернистый газ, используют для отбеливания шерсти, шелка, бумаги и соломы, а также в качестве консервирующих средств для сохранения свежих плодов и фруктов.
Сероводород H2S — бесцветный газ с резким запахом. Очень ядовит. Вызывает отравление даже при незначительном содержании в воздухе (около 0,01 %). Сероводород опасен тем, что может накапливаться в организме. Он соединяется с гемоглобином крови, что может привести к обморочному состоянию и смерти от кислородного голодания. В присутствии паров органических веществ токсичность H2S резко возрастает.
Вместе с тем H2S имеет лечебное значение, он является составной частью некоторых минеральных вод.
При растворении сероводорода в воде образуется слабая сероводородная кислота, соли которой называются сульфидами.
Сульфиды щелочных и щелочноземельных металлов, а также сульфид аммония хорошо растворяются в воде, сульфиды остальных металлов нерастворимы и окрашены в различные цвета, например, ZnS — белый, PbS — черный, MnS — розовый.
Сероводород горит. При охлаждении пламени (внесении в него холодных предметов) осаждается свободная сера:
![]()
Если же пламя не охлаждать и обеспечить избыток кислорода, то получается оксид серы (IV):
2H2S + 3O2 = 2H2O + 2SO2
Сероводород — сильнейший восстановитель.