Химия - Универсальный справочник школьника подготовка к ЕГЭ
Кислород - Особенности свойств водорода, хлора, брома, йода, кислорода, серы, азота, фосфора, углерода, кремния и их соединений - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Физические свойства кислорода
Кислород (О) — родоначальник главной подгруппы VI группы Периодической системы элементов. Элементы этой подгруппы — кислород О, сера S, селен Se, теллур Те, полоний Ро — имеют общее название «халькогены», что означает «рождающие руды».

Кислород — самый распространенный элемент на нашей планете. Он входит в состав воды (88,9 %), а ведь она покрывает 2/3 поверхности земного шара, образуя его водную оболочку — гидросферу. Кислород — вторая по количеству и первая по значению для жизни составная часть воздушной оболочки Земли — атмосферы, где на его долю приходится 21 % (по объему) и 23,15 % (по массе). Кислород входит в состав многочисленных минералов твердой оболочки земной коры — литосферы: из каждых 100 атомов земной коры на долю кислорода приходится 58 атомов.
Обычный кислород существует в форме О2. Это газ без цвета, запаха и вкуса. В жидком состоянии имеет светло-голубую окраску, в твердом — синюю. В воде газообразный кислород растворим лучше, чем азот и водород.
Химические свойства кислорода
Кислород взаимодействует почти со всеми простыми веществами, кроме галогенов, благородных газов, золота и платиновых металлов.
Реакции неметаллов с кислородом протекают очень часто с выделением большого количества тепла и сопровождаются воспламенением — реакции горения. Например, горение серы с образованием SO2, фосфора — с образованием P2O5 или угля — с образованием СО2.
- ЗАПОМНИ. Взаимодействие вещества с кислородом называют реакцией окисления.
Почти все реакции с участием кислорода экзотермические. Исключение составляет взаимодействие азота с кислородом: это эндотермическая реакция, которая протекает при температуре выше 1200 °С или при электрическом разряде:
![]()
Кислород энергично окисляет не только простые, но и многие сложные вещества, при этом образуются оксиды элементов, из которых они построены:
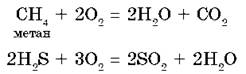
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и в процессах медленного окисления различных веществ при обычной температуре. Исключительно важна роль кислорода в процессе дыхания человека и животных. Растения также поглощают атмосферный кислород. Но если в темноте идет только процесс поглощения растениями кислорода, то на свету протекает еще один противоположный ему процесс — фотосинтез, в результате которого растения поглощают углекислый газ и выделяют кислород.
Получение кислорода
В промышленности кислород получают из жидкого воздуха, а в лаборатории — путем разложения пероксида водорода в присутствии катализатора диоксида марганца MnO2:
![]()
а также разложением перманганата калия KMnO4 при нагревании:
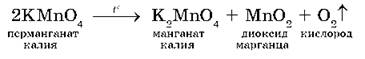
Применение кислорода
Кислород применяют в металлургической и химической промышленности для ускорения (интенсификации) производственных процессов. Чистый кислород применяют также для получения высоких температур, например, при газовой сварке и резке металлов.
В медицине кислород применяют в случаях временного затруднения дыхания, связанного с некоторыми заболеваниями. Также кислород применяют в металлургии как окислитель ракетного топлива, в авиации для дыхания, для резки металлов, для сварки металлов, при взрывных работах.
Кислород хранят в стальных баллонах, окрашенных в голубой цвет, под давлением 150 атм. В лабораторных условиях кислород хранят в стеклянных приборах — газометрах.