Химия - Универсальный справочник школьника подготовка к ЕГЭ
Аммиак. Соли аммония - Особенности свойств водорода, хлора, брома, йода, кислорода, серы, азота, фосфора, углерода, кремния и их соединений - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Строение молекулы аммиака
Известно, что на внешнем энергетическом уровне атомы азота содержат пять электронов, из которых три электрона — неспаренные. Именно они и участвуют в формировании трех ковалентных связей с тремя атомами водорода при образовании молекулы аммиака NH3:
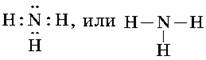
Три общие электронные пары смещены в сторону более электроотрицательного атома азота, а поскольку молекула аммиака имеет форму треугольной пирамиды, то в результате смещения электронных пар возникает диполь, т. е. система с двумя полюсами.
Физические и химические свойства аммиака
Аммиак — бесцветный газ с резким запахом, почти в два раза легче воздуха. Этот газ легко сжижается при обычном давлении и температуре -33,4 °С, а при испарении жидкого аммиака из окружающей среды поглощается много тепла, поэтому аммиак применяется в холодильных установках.
Аммиак очень хорошо растворим в воде: при 20 °С в одном объеме ее растворяется 710 объемов аммиака. Концентрированный водный раствор аммиака (25 % -й по массе) называется водным аммиаком, или аммиачной водой, а используемый в медицине раствор аммиака известен под названием нашатырный спирт. Тот нашатырный спирт, который имеется в вашей домашней аптечке, содержит 10 % аммиака.
Если в раствор аммиака добавить несколько капель фенолфталеина, то он окрасится в малиновый цвет, т. е. покажет щелочную среду:
![]()
Наличием гидроксид-ионов ОН- и объясняется щелочная реакция водных растворов аммиака. Если окрашенный фенолфталеином раствор аммиака подогреть, то окраска исчезнет.
Аммиак взаимодействует с кислотами, образуя соли аммония. Еще одно химическое свойство аммиака можно прогнозировать, если обратить внимание на степень окисления в нем атомов азота, а именно -3. Конечно же, аммиак — сильнейший восстановитель, т. е. атомы азота могут только отдавать электроны, но не принимать их. Так, аммиак способен окислятся или до свободного азота (без участия катализатора):
![]()
или до оксида азота (II) (в присутствии катализатора):
![]()
Донорно-акцепторный механизм образования иона аммония
Водный раствор аммиака и соли аммония содержат особый ион — катион аммония NH4+, играющий роль катиона металла. Он получается в результате того, что атом азота имеет свободную (неподеленную) электронную пару, за счет которой формируется еще одна ковалентная связь с катионом водорода, переходящего к аммиаку от молекул кислот или воды:
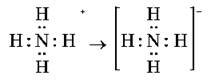
Такой механизм образования ковалентной связи, которая возникает не в результате обобществления непарных электронов, а благодаря свободной электронной паре, имеющейся у одного из атомов, называется донорно-акцепторным.
В данном случае донором этой свободной электронной пары служит атом азота в аммиаке, а акцептором — катион водорода или воды.
Получение аммиака
В промышленности аммиак производят при высоких температурах и давлении синтезом в присутствии катализатора из азота и водорода:
![]()
В лаборатории аммиак получают действием гашеной извести Ca(OH)2 на соли аммония, чаще всего на хлорид аммония:
![]()
Газ собирают в перевернутый кверху дном сосуд, а распознают или по запаху, или по посинению влажной красной лакмусовой бумажки, или по появлению белого дыма при внесенной палочке, смоченной соляной кислотой. Аммиак и его соли широко используются в промышленности и технике, в сельском хозяйстве, быту для производства минеральных удобрений, производства азотной кислоты, получения взрывчатых веществ, для паяния, в холодильных установках, в медицине.
Соли аммония
Соли аммония образуются катионом аммония NH4+, который играет роль катиона металла, и кислотными остатками: NH4NO3 — нитрат аммония, или аммиачная селитра; (NH4)2SO4 — сульфат аммония и т. д.
Все соли аммония — твердые кристаллические вещества, хорошо растворимые в воде. По ряду свойств они похожи на соли щелочных металлов, и в первую очередь на соли калия, т. к. радиусы ионов K+ и NH4+ приблизительно равны.
Соли аммония получают взаимодействием аммиака или его водного раствора с кислотами. Они обладают всеми свойствами солей, обусловленными наличием кислотных остатков.
Кроме того, ион аммония обусловливает другое, общее для всех солей аммония, свойство: его соли реагируют со щелочами при нагревании с выделением аммиака:
![]()
или в сокращенном виде:
NH4+ + OH- = NH3 + H2O
Эта реакция является качественной реакцией на соли аммония, т. к. образующийся аммиак легко обнаруживается по запаху или по образованию белого дыма при реакции его с соляной кислотой.
Третья группа свойств солей аммония — это их способность разлагаться при нагревании с выделением газообразного аммиака:
![]()
В этой реакции образуется газообразный хлороводород, который улетучивается вместе с аммиаком, а при охлаждении вновь соединяется с ним, образуя соль, т. е. при нагревании в пробирке сухой хлорид аммония как бы возгоняется, но на верхних холодных стенках пробирки снова появляются белые кристаллики NH4Cl.
Хлорид аммония NH4Cl используют при паянии, т. к. он очищает поверхность металла от оксидной пленки и к ней хорошо пристает припой.
Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 применяют в кондитерском деле, т. к. они легко разлагаются при нагревании и образуют газы, разрыхляющие тесто и делающие его пышным, например:
![]()
Нитрат аммония NH4NO3 в смеси с порошками алюминия и угля используют в качестве взрывчатого вещества — аммонала, который применяется при разработке горных пород.