Химия - Универсальный справочник школьника подготовка к ЕГЭ
Азот и его соединения - Особенности свойств водорода, хлора, брома, йода, кислорода, серы, азота, фосфора, углерода, кремния и их соединений - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Строение и свойства атомов
Азот (N) — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три электрона неспаренные. Отсюда следует, что атомы этих элементов могут присоединять три электрона, завершая внешний энергетический уровень.

Атомы азота могут отдавать свои внешние электроны более электроотрицательным элементам (фтору, кислороду) и приобретать при этом степени окисления +3 и +5. Атомы азота проявляют восстановительные свойства и в степенях окисления +1, +2, +4.
Азот — простое вещество
В свободном состоянии азот существует в воде двухатомной молекулы N2. В этой молекуле два атома N связаны очень прочной тройной ковалентной связью:

Эту связь можно обозначить и так:
N ≡ N
Азот — бесцветный газ без запаха и вкуса.
При обычных условиях азот взаимодействует только с литием, образуя нитрид Li3N:
6Li + N2 = 2Li3N
С другими металлами он взаимодействует только при высоких температурах.
Также при высоких температурах и давлении в присутствии катализатора азот реагирует с водородом, образуя аммиак:
![]()
При температуре электрической дуги он соединяется с кислородом, образуя оксид азота (II):
![]()
Применение азота
Азот, полученный перегонкой жидкого воздуха, в промышленности применяют для синтеза аммиака и производства азотной кислоты. В медицине чистый азот применяется в качестве инертной среды для лечения туберкулеза легких, а жидкий азот — при лечении заболеваний позвоночника, суставов и др.
Оксиды азота
Азот образует пять оксидов со степенями окисления +1, +2, +3, +4, +5.
Оксиды N2O и NO — несолеобразующие, а остальные оксиды — кислотные: ![]() соответствует азотистая кислота
соответствует азотистая кислота ![]() а
а ![]() — азотная кислота
— азотная кислота ![]() Оксид азота (IV) NO2 при растворении в воде образует одновременно две кислоты — HNO2 и HNO3.
Оксид азота (IV) NO2 при растворении в воде образует одновременно две кислоты — HNO2 и HNO3.
Оксид азота (IV) ![]() — бурый, очень ядовитый газ. Он легко получается при окислении кислородом воздуха бесцветного несолеобразующего оксида азота (II):
— бурый, очень ядовитый газ. Он легко получается при окислении кислородом воздуха бесцветного несолеобразующего оксида азота (II):
2NO + O2 = 2NO2
Азотная кислота
HNO3 — бесцветная жидкость, которая «дымится» на воздухе. Азотная кислота проявляет все типичные свойства сильных кислот: взаимодействует с оксидами и гидроксидами металлов, с солями. Но вот с металлами она ведет себя по-особому — ни один из металлов не вытесняет из азотной кислоты водород, независимо от ее концентрации (для серной кислоты такое поведение характерно только в ее концентрированном состоянии). При взаимодействии с медью концентрированная азотная кислота восстанавливается до оксида азота (IV):
![]()
а разбавленная — до оксида азота (II):
![]()
Железо и алюминий при действии концентрированной HNO2 покрываются прочной оксидной пленкой, предохраняющей металл от дальнейшего окисления, т. е. кислота пассивирует их. Поэтому азотную кислоту, как и серную, можно перевозить в стальных и алюминиевых цистернах.
Азотная кислота окисляет многие органические вещества, обесцвечивает красители. При этом обычно выделяется много теплоты и вещество воспламеняется. Так, если в азотную кислоту добавить каплю скипидара, то происходит яркая вспышка, а тлеющая лучинка в ней загорается (рис. 14).
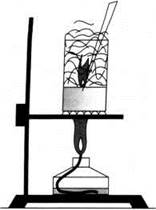
Рис. 14. Горение лучинки в азотной кислоте
Азотная кислота широко применяется в химической промышленности для производства азотных удобрений, пластмасс, искусственных волокон, органических красителей и лаков, лекарств и взрывчатых веществ.
Соли азотной кислоты — нитраты — получают при действии кислоты на металлы, их оксиды и гидроксиды. Нитраты натрия, калия, кальция и аммония, называются селитрами: NaNO3 — натриевая селитра, KNO3 — калийная селитра, Ca(NO3)2 — кальциевая селитра, NH4NO3 — аммиачная селитра. Все они применяются как азотные удобрения.
Калийная селитра используется также при изготовлении черного пороха, а из аммиачной селитры готовят взрывчатое вещество аммонал. Нитрат серебра AgNO3, или ляпис, применяется в медицине для прижигания ран, язв и т. д.
Почти все нитраты хорошо растворимы в воде. При нагревании они разлагаются с выделением кислорода:
![]()