Химия - Универсальный справочник школьника подготовка к ЕГЭ
Щелочные металлы (Na, K) - Металлы главных подгрупп I-III групп Периодической системы химических элементов Д. И. Менделеева - НЕОРГАНИЧЕСКАЯ ХИМИЯ
На внешнем энергетическом уровне атомы щелочных металлов элементов содержат по одному электрону, находящемуся на большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1. Их восстановительные свойства с ростом радиуса атомов усиливаются от Li к Cs. Все они типичные металлы, имеют серебристо-белый цвет, мягкие (режутся ножом), легкие и легкоплавкие. Активно взаимодействуют со всеми неметаллами:
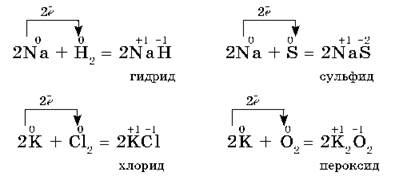
Все щелочные металлы при взаимодействии с кислородом (исключение Li) образуют пероксиды. В свободном виде щелочные металлы не встречаются из-за их высокой химической активности.
Оксиды — твердые вещества, имеют основные свойства. Их получают, прокаливая пероксиды с соответствующими металлами:
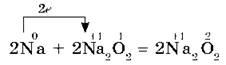
Гидроксиды NaOH, KOH — твердые белые вещества, гигроскопичны, хорошо растворяются в воде с выделением теплоты, их относят к щелочам:
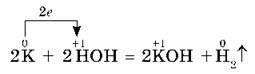
Соли щелочных металлов почти все растворимы в воде. Важнейшие из них: Na2CO3 — карбонат натрия; Na2CO3 · 10H2O — кристаллическая сода; NaHCO3 — гидрокарбонат натрия, пищевая сода; K2CO3 — карбонат калия, поташ; Na2SO4 · 10H2O — глауберова соль; NaCl — хлорид натрия, пищевая соль.