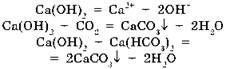Химия - Универсальный справочник школьника подготовка к ЕГЭ
Щелочноземельные металлы (Ca, Mg) - Металлы главных подгрупп I-III групп Периодической системы химических элементов Д. И. Менделеева - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Кальций (Ca) является представителем щелочноземельных металлов, которыми называются элементы главной подгруппы II группы, но не все, а только начиная с кальция и вниз по группе. Это те химические элементы, которые, взаимодействуя с водой, образуют щелочи. Кальций на внешнем энергетическом уровне содержит два электрона, степень окисления +2.

Физические и химические свойства кальция и его соединений представлены в таблице 9.
Таблица 9
Кальций и его соединения
|
Кальций |
Оксид и гидроксид кальция |
Соли кальция |
|
1. Серебристо-белый металл. 2. Активный металл, окисляется простыми веществами-неметаллами: 2Са + О2 = 2СаО Са + Сl2 = СаСl2 Ca + S = CaS Са + Н2 = СаН2 3. Вытесняет водород из воды:
4. Вытесняет металлы из их оксидов (кальциетермия): 2Са + ThO2 = Th + 2СаО Получение: разложение электрическим током расплава хлорида кальция: СаСl2 = Са + Сl2 |
1. Порошки белого цвета. 2. Оксид кальция (негашеная известь) проявляет свойства основного оксида: а) взаимодействует с водой с образованием основания: СаО + Н2O = Са(ОН)2 б) взаимодействует с кислотными оксидами: СаО + SiO2 = CaSiO3 3. Гидроксид кальция проявляет свойства сильного основания:
Получение: 1. Оксида — обжигом известняка:
2. Гидроксида — гашением негашеной извести: СаО + Н2O = Са(ОН)2 |
1. Образует нерастворимый карбонат:
и растворимый гидрокарбонат:
2. Образует нерастворимый фосфат:
и растворимый дигидрофосфат:
3. Гидрокарбонат разлагается при кипячении или испарении раствора:
4. Обожженный природный гипс
затвердевает при взаимодействии с водой, снова образуя кристаллогидрат:
|
Магний (Mg) имеет такое же строение атома, как и кальций, степень его окисления также +2.
Мягкий металл, но его поверхность на воздухе покрывается защитной пленкой, что немного снижает химическую активность. Его горение сопровождается ослепительной вспышкой. MgO иMg(OH)2 проявляют основные свойства. Хотя Mg(OH)2 и малорастворим, но окрашивает раствор фенолфталеина в малиновый цвет.
Оксиды MO — твердые белые тугоплавкие вещества. В технике CaO называют негашеной известью, а MgO — жженой магнезией, эти оксиды используют в производстве строительных материалов.
Реакция оксида кальция с водой сопровождается выделением теплоты и называется гашением извести, а образующийся Ca(OH)2 — гашеной известью. Прозрачный раствор гидроксида кальция называется известковой водой, а белая взвесь Ca(OH)2 в воде — известковым молоком.
- ЗАПОМНИ. Be, Mg и щелочноземельные металлы легкие серебристо-белого цвета, Sr имеет золотистый оттенок. На воздухе поверхность Be и Mg покрывается оксидной пленкой.
Соли магния и кальция получают взаимодействием их с кислотами.
CaCO3 — карбонат кальция, мел, мрамор, известняк. Применяется в строительстве. MgCO3 — карбонат магния — применяется в металлургии для освобождения от шлаков. CaSO4 · 2H2O — гипс. MgSO4 — сульфат магния — называют горькой, или английской, солью, содержится в морской воде. BaSO4 — сульфат бария — благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в диагностике («баритовая каша») желудочно-кишечного тракта.
На долю кальция приходится 1,5 % массы тела человека, 98 % кальция содержится в костях. Магний является биоэлементом, его в теле человека около 40 г, он участвует в образовании белковых молекул.
- ЗАПОМНИ. Соли кальция Ca(HCO3)2, CaSO4 и соли магния Mg(HCO3)3, MgSO4 обусловливают общую жесткость воды.