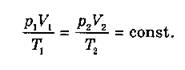Физика: Универсальный справочник
Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа) - Молекулярная физика - МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА
2.1.9.Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа)
Уравнение состояния идеального газа — это зависимость между параметрами идеального газа — давлением р, объемом V и абсолютной температурой Т, определяющими его состояние:
![]()
где В зависит от массы газа т и его молекулярной массы М. В таком виде уравнения впервые получено в 1834 г. французским ученым Б. П. Э. Клапейроном и называется уравнением Клапейрона.
В 1874 г. Д. И. Менделеев вывел уравнение состояния для одного моля идеального газа: pV = RT, где R — универсальная газовая постоянная. Если молярная масса газа — М, то:
![]()
Уравнение состояния в форме (2.14) называется уравнением Клапейрона—Менделеева. Оно объединяет газовые законы Гей-Люссака, Бойля-Мариотта, Авогадро, Шарля.
Уравнение состояния (2.14) может быть получено из зависимости давления от температуры р = nkT (2.12), если в нее подставить концентрацию молекул n из выражения

где NA — постоянная Авогадро, N — число молекул в теле.
В результате получим:
![]()
где kNA = R — универсальная газовая постоянная, равная 8,31 · 1023 Дж/моль-К; k — постоянная Больцмана, равная 1,38 · 10-23 Дж/К. Заменив в (2.16) kNA на R, получаем уравнение состояния в виде (2.14). Отношение уравнений (2.14) или (2.13) при двух наборах параметров p1, V2, Т1 и р2, V2, Т2 дает: