Физика: Универсальный справочник
Изопроцессы в газах - Молекулярная физика - МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА
Изопроцессами называются процессы, протекающие при неизменном значении одного из параметров: давления (р), объема (F), температуры (Г).
В идеальном газе эти процессы подчиняются газовым законам.
Газовыми законами называются количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра.
Закон Бойля-Мариотта
Закон Бойля-Мариотта — один из основных газовых законов, он описывает изотермические процессы в газе.
Процесс изменения состояния термодинамической системы при постоянной температуре называется изотермическим.
Закон гласит:
Для данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
![]()
Этот закон был экспериментально открыт английским ученым Р. Бойлем в 1662 г., в 1676 г. его сформулировал также французский ученый Э. Мариотт.
Закон строго выполняется только для идеальных газов. Для реальных газов он выполняется достаточно хорошо при небольших давлениях и высоких температурах. Так, при давлении 100 атм и температуре 0°С отклонение измеренного значения pV от расчетного составляет 7%. Закон Бойля-Мариотта, как и другие газовые законы, является следствием уравнения состояния идеального газа.
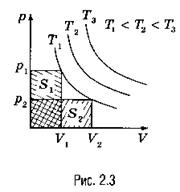
Графики зависимости p(V) при Т = const (р = const/F) называются изотермами и представляют собой равносторонние гиперболы (площади S1 = S2). Чем выше температура, тем выше лежит соответствующая ей изотерма (рис. 2.3).
Закон Шарля
Давление р данной массы газа при постоянном объеме пропорционально температуре.
![]()
Закон был открыт французским физиком Ж. Шарлем в 1787 году.
Процесс изменения состояния термодинамической системы при постоянном объеме называется изохорным (от греч. hora — пространство).
Закон Шарля, как и другие газовые законы, является следствием уравнения состояния идеального газа.
![]()
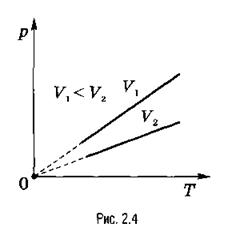
Согласно (2.17), давление газа линейно зависит от температуры при постоянном объеме. Эта зависимость изображается прямой, которая называется изохорой (рис. 2.4). С ростом объема газа при постоянной температуре давление его, согласно закону Бойля-Мариотта, падает. Поэтому изохора, соответствующая большему объему, лежит ниже изохоры, соответствующей меньшему объему.
В соответствии с (2.17), все изохоры начинаются в точке Т = 0 (давление идеального газа при абсолютном нуле равно нулю).
Изохорный процесс используется в газовых термометрах постоянного объема.
Закон Гей-Люссака
При постоянном давлении р объем V идеального газа меняется линейно с температурой.
То есть
![]()
где Vo — начальный объем, t — разность начальной и конечной температур. Коэффициент теплового расширения идеальных газов а = (1/273,15) К -1 одинаков для всех газов.
Процесс изменения состояния термодинамической системы при постоянном давлении называется изобарным (от греч. baros — вес, тяжесть).
Закон открыт французским ученым Ж. Гей-Люссаком в 1802 г. и независимо от него Дж. Дальтоном в 1801 г.
Закон Гей-Люссака, как и другие газовые законы, является следствием уравнения состояния идеального газа. Это становится очевидным, если в (2.18) заменить t на абсолютную температуру T = t + 273,15, а коэффициент расширения α — его численным значением 1/273,15:
![]()
или
![]()
Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется.
Согласно (2.19), объем газа линейно зависит от температуры при постоянном давлении:
![]()
Эта зависимость графически изображается прямой, которая называется изобарой (рис. 2.5).
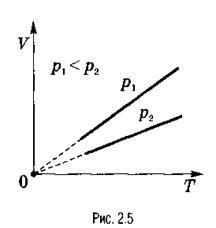
Различным давлениям соответствуют разные изобары. С ростом давления объем газа при постоянной температуре, согласно закону Бойля-Мариотта, уменьшается, поэтому изобара, соответствующая более высокому давлению р2, лежит ниже изобары, соответствующей более низкому давлению р1.
В области низких температур все изобары идеального газа сходятся в точке Т = 0, но это не означает, что объем реального газа действительно обращается в нуль. При низких температурах все газы обращаются в жидкости, а к жидкостям уравнение состояния не применимо.