Физика: Универсальный справочник
Свойства тел в разных агрегатных состояниях - Молекулярная физика - МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА
Агрегатные состояния вещества (от лат. aggrego — присоединяю) — это состояния одного и того же вещества в различных интервалах (промежутках) температур и давлений.
Агрегатными состояниями принято считать газообразное, жидкое и твердое.
Самыми простыми примерами существования одного и того же вещества в этих трех агрегатных состояниях, которые наблюдаются в повседневной жизни, являются лед, вода и водяной пар. Невидимый водяной пар всегда присутствует и в окружающем нас воздухе. Вода существует в интервале температур от 0°С до 100°С, лед — при температуре ниже 0°С. При температуре выше 100 °С и нормальном атмосферном давлении молекулы воды существуют только в газообразном состоянии — в виде водяного пара. Вода, лед и водяной пар — это одно и то же вещество с химической формулой Н2O.
Многие вещества в обыденной жизни мы наблюдаем только в одном из агрегатных состояний. Так, кислород в окружающем нас воздухе представляет собой газ. Но при температуре -193 °С он превращается в жидкость. Охладив эту жидкость до -219 °С, мы получим твердый кислород. И наоборот, железо в обычных условиях твердое. Однако при температуре 1535 °С железо плавится и превращается в жидкость. Над расплавленным железом будет находиться газ — пар из атомов железа.
Различные агрегатные состояния существуют у каждого вещества. Отличаются эти вещества не молекулами, а тем, как эти молекулы расположены и как движутся. Расположение молекул воды в трех агрегатных состояниях показано на рис. 2.6.
Переход из одного агрегатного состояния в другое. При определенных условиях вещества могут переходить из одного агрегатного состояния в другое. Все возможные при этом превращения отображены на рис. 2.7.

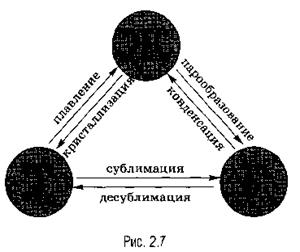
Всего различают шесть процессов, при которых происходят агрегатные превращения вещества.
Переход вещества из твердого (кристаллического) состояния в жидкое называется плавлением, обратный процесс называется кристаллизацией, или отвердеванием. Пример плавления — таяние льда, обратный процесс происходит при замерзании воды.
Переход вещества из жидкого состояния в газообразное называется парообразованием, обратный процесс называется конденсацией. Пример парообразования — испарение воды, обратный процесс можно наблюдать при выпадении росы.
Переход вещества из твердого состояния сразу в газообразное (минуя жидкое) называется сублимацией, или возгонкой, обратный процесс называется десублимацией. Например, графит можно нагреть до тысячи, двух тысяч и даже трех тысяч градусов и, тем не менее, в жидкость он не превратится: он будет сублимироваться, т. е. из твердого состояния сразу переходить в газообразное. Непосредственно в газообразное состояние (минуя жидкое) переходит и так называемый сухой лед (твердый оксид углерода СO2), который можно увидеть в контейнерах для транспортировки мороженого. Все запахи, которыми обладают твердые тела (например, нафталин), также обусловлены возгонкой: вылетая из твердого тела, молекулы образуют над ним газ (или пар), обладающий запахом.
Примером десублимации является образование на окнах зимой узоров из кристалликов льда. Эти красивые узоры образуются при десублимации водяного пара, находящегося в воздухе.
Переходы вещества из одного агрегатного состояния в другое играют важную роль не только в природе, но и в технике. Так, воду, превращенную в пар, можно использовать в паровых турбинах на электростанциях. Из расплавленных металлов на заводах получают различные сплавы: сталь, чугун, латунь и т. д. Для понимания этих процессов надо знать, что происходит с веществом при изменении его агрегатного состояния и при каких условиях это изменение возможно.