Настольная книга учителя химии 10 класс - поурочные разработки
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ, ИХ СТРОЕНИЕ, ИЗОМЕРИЯ, НОМЕНКЛАТУРА - УГЛЕВОДОРОДЫ
Цели урока. Рассмотреть электронное и пространственное строение молекулы бензола. На основе внутрипредметных связей с диенами развивать понятие о сопряжении. Познакомить учащихся с гомологами, номенклатурой и изометрией аренов, а также с их физическими свойствами.
Оборудование: бензол, настойка йода; плакат «Электронное и пространственное строение бензола», модели молекул Стюарта — Бриглеба.
I. Немного истории
Циклоалканы — не единственный класс веществ, содержащих замкнутую цепочку углеродных атомов. В органической химии имеется огромное количество соединений, отличительная черта которых — наличие шестичленного углеродного кольца с высокой степенью ненасыщенности. С подобными веществами ученые столкнулись очень давно, они широко распространены в природе. Впервые бензол описал немецкий химик Иоганн Глаубер. Он получил это соединение в 1649 г. в результате перегонки каменноугольной смолы. Но ни названия вещество не получило, ни состав его не был известен. Поэтому второе свое рождение бензол получил благодаря работам выдающегося английского химика и физика — Майкла Фарадея.
В начале XIX в. на улицах больших городов — Лондона, Петербурга, Берлина — появилось газовое освещение. В специальных фонарях горел светильный газ, получаемый из китового и трескового жира. Газ хранился в железных баллонах под давлением 30 атм. Зимой яркость свечения уменьшалась, а в баллонах образовывался жидкий конденсат. Именно из такого конденсата М. Фарадей в 1825 г. выделил 3 г углеводорода, имеющего состав С6Н6. Девять лет спустя то же вещество получил Э. Мигчерлих путем нагревания бензойной кислоты с гидроксидом кальция.
Название нового вещества несколько раз менялось. Фарадей называл его «карбюрированный водород», а Митчерлих — бензином. Вскоре Юстус Либих переименовал его в бензол (от арабских слов ben - аромат + zоа - сок + латинское слово ol[eum] - масло). В 1837 г. с подачи Огюста Лорана появилось еще одно название — фен (от греческого phainx— освещать), в знак того, что бензол был обнаружен в светильном газе. Это название трансформировалось в название радикала фенил С6Н5.
В 40-60-х гг. XIX в. было обнаружено, что множество природных соединений содержало шестичленный бензольный цикл. Многие из этих веществ обладали приятным запахом, поэтому по предложению Кеккуле (I860 г.) такие вещества объединили в одну группу под общим названием ароматические соединения. Это не совсем химически правильное название прижилось: бензол и его гомологи стали называть ароматическими углеводородами.
По содержанию в молекуле атомов водорода было ясно, что ароматические углеводороды имеют непредельный характер. На бензол и полученные вскоре его гомологи был обрушен весь имеющийся арсенал методов исследования, как химических, так и физических. Ко всеобщему удивлению, вещество не обладало склонностью к реакциям присоединения, то есть не напоминало алкены, а по характерным для него реакциям замещения походило скорее на алканы. Началась увлекательная история установления структурной формулы бензола.
Впервые наличие цикла в бензоле предположил в 1861 г. австрийский ученый Иоганн Лошмидт. В 1865 г. уже знакомый ребятам по своим работам в области теоретической органический химии немецкий химик-органик Фридрих Август Кеккуле предложил свою знаменитую формулу бензола с чередующимися двойными и одинарными связями в шестичленном цикле. Формула Кеккуле хорошо объясняла многие свойства бензола, например, существование только одного монозамещенного производного (рис. 16). Но противники Кеккуле упорствовали: как же быть с отсутствием у бензола непредельных свойств и существованием одного, а не двух изомерных 1,2-дизамещенных производных (теоретически структуры В и Г должны различаться)?
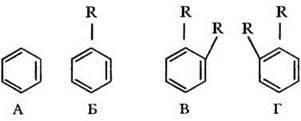
Рис. 16. Достоинства и недостатки структуры Кеккуле; равноценность всех атомов углерода (А), существование единственного монозамещённого производного (Б), неподтверждённая возможность существования двух изомеров (В и Г)
Изучением природы двойных связей в бензоле занимались многие выдающиеся химики, приближаясь постепенно к пониманию истинного строения его молекулы. Современное представление об электронной природе связей в бензоле основывается на гипотезе выдающегося американского физика и химика, дважды лауреата Нобелевской премии Лайнуса Полинга. Именно по предложению Полинга молекулу бензола стали изображать в виде шестиугольника с вписанной окружностью, подчеркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
Как же устроена молекула бензола? От исторического экскурса учитель переходит к объяснению электронного и пространственного строения молекулы бензола.
II. Электронное и пространственное строение бензольного кольца
Если позволяет время, учитель просит ребят вспомнить электронное строение сопряженных алкадиенов. В каком состоянии гибридизации находятся атомы углерода в бутадиене-1,3? Как за счет негибридизованных p-орбиталей образуется общее электронное облако?
Подобные аналогии прослеживаются и в циклической сопряженной молекуле — бензоле.
Все шесть атомов углерода в бензоле также находятся в состоянии sp2-гибридизации. Учащиеся должны обязательно вспомнить, каким набором орбиталей обладает такой атом углерода и как они расположены в пространстве (три гибридные sp2-орбитали имеют форму несимметричной восьмёрки, их оси лежат в одной плоскости под углом 120°; ось негибридизованной p-орбитали перпендикулярна этой плоскости).
За счёт двух sp2-гибридных орбиталей каждый атом образует σ-связи с двумя соседними углеродными атомами, за счёт третьей sp2-орбитали — σ-связь с атомом водорода. У каждого углеродного атома цикла остаётся по одной негибридизованной р-орбитали. Оси этих орбиталей параллельны, и каждая из них перекрывается с двумя соседними, образуя единые электронные облака над и под плоскостью кольца. Таким образом, нельзя говорить о чередовании простых и двойных связей в цикле, р-электронные облака делокализованы по всему кольцу и обеспечивают равноценность всех С—С связей. Они носят полуторный или ароматический характер (рис. 17).
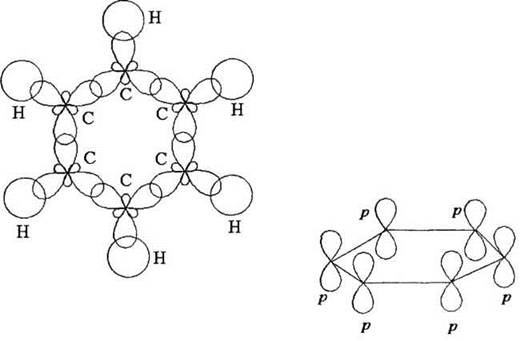
Рис. 17. σ- и π-связи в молекуле бензола
С учетом равноценности углерод-углеродных связей в молекуле бензола Л. Полинг и предложил изображать его формулу в виде правильного шестиугольника с вписанной окружностью, символизирующей делокализацию электронной плотности. Атомы водорода можно не изображать, подразумевая их наличие и четырехвалентное состояние углерода. В настоящее время общепринятыми и допустимыми обозначениями являются и формула Кеккуле, и структура Полинга.
Электронное строение молекулы бензола обусловливает его пространственное строение. Центры ядер всех двенадцати атомов лежат в одной плоскости. Длины шести связей С—С равны между собой и составляют 0,139 нм, что имеет промежуточное значение между длиной простой (0,154 нм) и двойной (0,132 нм) связи. Длины связей С—Н составляют 0,108 нм.
Все валентные углы ∠HCC и ∠CCC равны 120° , что в точности равно углу между осями sp2-гибридных орбиталей. Это свидетельствует об отсутствии в бензоле узлового напряжения.
Каждый учитель знает, насколько трудно научить ребят не забывать изображать окружность в бензольном цикле (или расставлять двойные связи). Стоит еще раз изобразить рядом молекулы циклогексана и бензола, показать их различие.
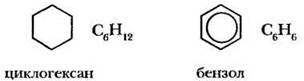
Нельзя путать эти две формулы! Это совершенно разные вещества. Циклогексан содержит 12 атомов водорода (по два у каждого углеродного атома), а бензол — только 6. Различие же в электронном строении этих соединений обусловливает несовпадение их химических свойств.
III. Изомерия и номенклатура гомологов бензола
Бензол является родоначальником гомологического ряда ароматических углеводородов (аренов). Учитель напоминает, что каждый последующий гомолог отличается от предыдущего на гомологическую разность СН2. Чтобы вывести формулу второго представителя гомологического ряда аренов, надо один из атомов углерода бензола заменить на метильную группу. Увеличивать размер цикла (до семичленного) нельзя! По международной номенклатуре это вещество называется метилбензол, однако чаще употребляется тривиальное название толуол. Поскольку все атомы водорода в бензоле абсолютно одинаковы, у толуола изомеров нет. Как получить формулу следующего гомолога? Нужно один из водородных атомов в толуоле заместить на метильную группу. Учитель ставит проблемную ситуацию: сколько изомеров у данного гомолога? В толуоле 4 группы атомов водорода, отличающихся друг от друга. Значит, и изомеров четыре. С помощью учащихся учитель изображает их формулы на доске.
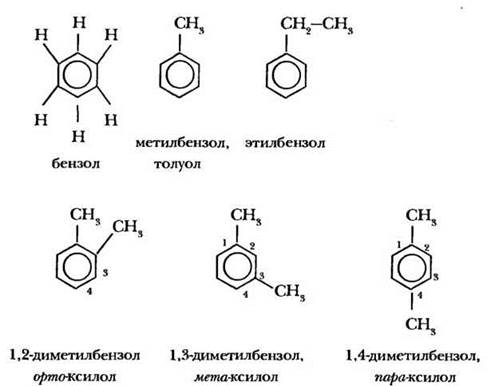
Как же называют дизамещенные производные бензола? Атомы углерода цикла нумерую от старшего заместителя к младшему кратчайшим путем, указывают положение заместителя, его наименование. Основа названия — слово «бензол». Общее тривиальное название всех изомерных диметилбензолов — ксилол.
Ребята настолько привыкают к международной номенклатуре, что так называть соединения им проще. Но для дизамещенных производных бензола химикам ближе иное обозначение изомеров. Учитель поясняет, что мы имеем дело с особым видом структурной изомерии. Изомеры отличаются взаимным расположением заместителей в бензольном кольце. Ученик Кеккуле В. Кернер ввел для обозначения взаимного положения двух заместителей в ядре особые термины, заимствованные из греческого языка. Для расположенных рядом заместителей он предложил использовать приставку орто- (orthos - прямой), для находящихся через один атом углерода — мета- (meta - после), для находящихся напротив — пара- (para - напротив). Это полезные термины, их желательно запомнить и не путать. Таким образом, существуют три изомерных ксилола — орто-ксиллол, мета-ксилол, пора-ксилол.
Вывести общую формулу аренов учащиеся обычно затрудняются. Выписав молекулярные формулы первых трех гомологов, они пытаются найти соотношение между индексами: С6Н6, C7H8,C8H10. Однако лучше рассуждать по-другому. Бензол по составу отличается от своего «коллеги-алкана» на 8 атомов водорода. За счет отщепления 2-х атомов замыкается цикл, еще три пары приходится убрать для образования трех формально двойных связей. Сказанное справедливо для любого гомолога. Значит, все арены по сравнению с алканами содержат на 8 атомов водорода меньше: СnH2n+2-8 или СnH2n-6.
В заключение учитель просит ребят запомнить еще два важных термина: названия простейших радикалов С6Н5 — фенил и С6Н5СН2 — бензил.
IV. Физические свойства аренов
Первые члены гомологического ряда бензола — бесцветные летучие жидкости с характерным запахом, плотностью меньше 1 г/мл, в воде не растворяются, однако сами являются хорошими растворителями органических и некоторых неорганических веществ. В гомологическом ряду с увеличением молекулярной массы углеводорода увеличиваются его температуры кипения и плавления, а также плотность.
Учитель демонстрирует ребятам нерастворимость бензола (или толуола) в воде, поместив в пробирку 5-6 мл воды и 1-2 мл органического вещества. Границу раздела двух фаз практически не видно, но, если интенсивно встряхнуть пробирку, образуется мутная эмульсия — значит, бензол в воде растворяется плохо. Постепенно эмульсия расслаивается, и капельки органического вещества всплывают наверх: бензол легче воды. Учитель добавляет в пробирку несколько капель йодной настойки, встряхивает и дает системе расслоиться. Водный слой бесцветный, а бензольный окрашивается в красивый темно-красный цвет. Йод значительно лучше растворяется в бензоле, чем воде.
Для учащихся 2-го уровня неплохо записать и запомнить определение:
Извлечение вещества из раствора с помощью другого растворителя, не смешивающегося с данным, называется экстракцией. |
Учитель помещает в пробирку несколько очищенных раздавленных в ступке подсолнечных семечек и добавляет 1 мл бензола. После нескольких интенсивных встряхиваний одна капля жидкости помещается на фильтровальную бумагу. После испарения бензола на бумаге остается жирное пятно. Органический растворитель экстрагирует растительные масла из клеточного сока. С водой такой опыт не удастся. Еще эффектнее опыт получается с косточками облепихи, поскольку облепиховое масло окрашено.
Осторожно! Все опыты с ароматическими углеводородами проводить в вытяжном шкафу!
В классе и с помощью домашнего задания необходимо закрепить вопросы строения, изомерии и номенклатуры ароматических углеводородов.
Задание .
1-й уровень
Напишите формулу пропилбензола. Укажите состояние гибридизации всех атомов углерода.
2-й уровень
Сравните электронное и пространственное строение молекул циклогексана и бензола.
Задание 2
1-й уровень
Сколько изомерных триметилбензолов может существовать? Напишите их структурные формулы и назовите по международной номенклатуре.
2-й уровень
Определите молекулярную формулу ароматического углеводорода, содержащего 90,0% углерода.