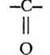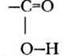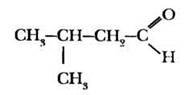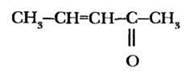Настольная книга учителя химии 10 класс - поурочные разработки
ОБОБЩАЮЩИЙ УРОК ПО ТЕМЕ «КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ» - УГЛЕВОДЫ
Цели урока. Повторить, обобщить и систематизировать знания по кислородсодержащим органическим соединениям, в том числе и на основе генетической связи между классами этого типа веществ. Подготовить к выполнению контрольной работы по теме.
I. Классификация кислородсодержащих органических соединений
В качестве домашнего задания при подготовке к уроку учащиеся повторили параграфы учебника, касающиеся строения, способов получения и химических свойств кислородсодержащих органических веществ. Этот раздел достаточно объемен, поэтому задача учителя и учащихся на данном уроке сводится не к простому повторению материала, а к его систематизации, нахождению общих черт и различий между кислородсодержащими функциональными группами, способов перехода от соединений одного класса к другому.
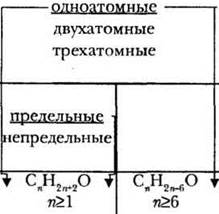
Начать обобщение материала следует с классификации рассматриваемых классов веществ. Учитель может воспользоваться плакатом или слайдом, примерный вид которого представлен на рисунке 39.
|
|
Гидроксилсодержащие соединения |
Карбонильные соединения |
Карбоновые кислоты |
||
|
Функциональная группа |
-ОН |
|
|
||
|
Классы веществ |
Спирты |
Фенолы |
Альдегиды |
Кетоны |
Карбоновые кислоты |
|
Особенности структуры |
|
|
|
|
- |
|
Классификация по числу функциональных групп |
|
|
|
||
|
Классификация по типу углеводородного радикала |
|||||
|
Общая формула |
|||||
Рис. 39. Примерный вид плаката по классификации кислородсодержащих соединений
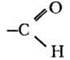
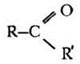
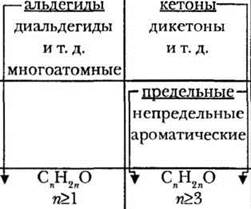
В органической химии существует три важнейших функциональных группы, включающих атомы кислорода: гидроксильная, карбонильная и карбоксильная. Последнюю можно рассматривать как сочетание двух предыдущих. В зависимости от того, с какими атомами или группами атомов связаны данные функциональные группы, кислородсодержащие вещества делятся на спирты, фенолы, альдегиды, кетоны и карбоновые кислоты.
Ребята уже знают, что это не единственно возможный признак классификации. Одинаковых функциональных групп в молекуле может быть несколько, и учитель обращается к соответствующей строке таблицы.
Следующая строка отражает классификацию веществ по типу радикала, связанного с функциональной группой. Учитель обращает внимание на то, что в отличие от ароматических альдегидов, кетонов и карбоновых кислот, ароматические спирты выделяют в отдельный класс соединений — фенолы.
Число функциональных групп и строение радикала определяют общую молекулярную формулу веществ. В данной таблице они приведены только для предельных представителей классов с одной функциональной группой.
Все классы соединений, «уместившиеся» в таблицу, являются монофункциональными, то есть содержат только один вид кислородсодержащей функции. Но изученный раздел завершали соединения, в молекулах которых сосуществовало несколько типов функциональных групп. Это бифункциональные соединения — углеводы. Учащиеся вспоминают, что моносахариды по химическому строению относятся к классу альдегидоспиртов или кетоноспиртов.
Для закрепления материала по классификации, а заодно и номенклатуре кислородсодержащих веществ, учитель приводит несколько формул соединений и просит учащихся определить «их место» в приведенной классификации и дать название.
|
|
2-бутеновая кислота, |
непредельная |
|
|
2,4-диметилфенол, |
одноатомный |
|
|
пропандионовая кислота, |
предельная, двухосновная |
|
|
пропиновая кислота, |
непредельная, одноосновная |
|
|
бутандиол-1,4, |
предельный, двухатомный |
|
|
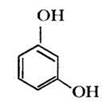
1,3-дигидроксибензол, |
двухатомный фенол |
|
|
3-метилбутаналь. |
предельный альдегид |
|
|
бутен-3-он-2, |
непредельный кетон |
|
|
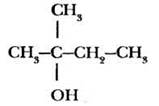
2-метилбутанол-2. |
предельный, одноатомный |
II. Генетическая связь между различными классами кислородсодержащих соединений
Учитель изображает на доске формулы ряда соединений, содержащих по одному атому углерода:
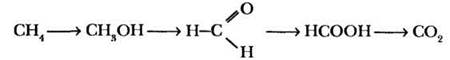
Почему именно в такой последовательности они изучаются в курсе органической химии? Почему ряд заканчивается неорганическим веществом (углекислым газом)?
Учитель просит ребят рассчитать массовую долю кислорода в четырех последних веществах (можно работать по вариантам) и дополняет запись строчкой:
![]()
Очевидно, что массовая доля кислорода в ряду возрастает. А как изменяется степень окисления (СО) атома углерода? Учащиеся диктуют третью строчку:
![]()
Теперь становится ясно, что каждое последующее соединение является все более окисленной формой предыдущего. Отсюда очевидно, что продвигаться по генетическому ряду слева направо следует с помощью реакций окисления, а в обратном направлении — с использованием процессов восстановления. Учитель предлагает ребятам записать уравнения реакций, соответствующих переходам по стрелкам:
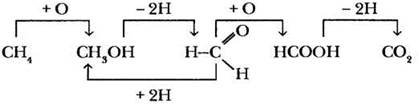
Не выпадают ли из этого «круга родственников» кетоны? Конечно, нет. Их предшественники — вторичные спирты.
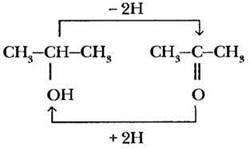
А вот дальше окислить кетон без разрушения углерод-углеродной цепочки нельзя.
Чтобы из рассмотрения не выпадали углеводы, учитель также находит им генетических предшественников. В 1861 г. А. М. Бутлеров осуществил реакцию полимеризации формальдегида в присутствии гидроксида кальция. Продуктом оказалась смесь углеводов, изомерных глюкозе:
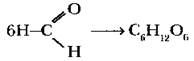
Практического применения эта реакция до сих пор не нашла, но она является ярким примером генетической связи между относительно простым кислородсодержащим веществом и природными полифункциональными соединениями сложного строения.
Задания по взаимопревращениям кислородсодержащих веществ ребята в большом количестве выполняли при изучении отдельных классов соединений, поэтому на уроке обобщения желательно преподнести их в несколько необычной форме. В качестве примера даны варианты заданий для общеобразовательного и профильного уровней изучения химии.
1-й уровень. Соединение с молекулярной формулой C3H8O подвергли окислительному дегидрированию, в результате чего получили продукт состава C3H6O. Это вещество вступает в реакцию «серебряного зеркала», образуя соединение C3H6О2. При действии на последнее гидроксидом кальция получили вещество, используемое в качестве пищевой добавки под кодом Е282. Оно препятствует росту плесени в хлебобулочных и кондитерских изделиях и, кроме того, содержится в таких продуктах, как швейцарский сыр. Определите формулу добавки Е282, напишите уравнения упомянутых реакций и назовите все органические вещества. (Пропионат кальция.)
2-й уровень. Ароматический углеводород состава C7H8 подвергли бромированию на свету без катализатора. Образовавшееся дибромпроизводное гидролизовали разбавленным раствором гидроксида натрия. Полученный продукт окислили кислородом воздуха при нагревании. Получили вещество состава С7Н6О2, которое широко распространено в природе. Это соединение используется в пищевой промышленности в качестве добавки Е210. Его добавляют в джемы, фруктовые соки, маринады, йогурты в качестве бактерицидного и противогрибкового средства (консерванта). Определите формулу пищевой добавки Е210, напишите уравнения всех упомянутых реакций и назовите вещества. (Бензойная кислота.)
III. Взаимосвязь строения и свойств кислородсодержащих соединений
Природа функциональной группы оказывает существенное влияние на физические свойства веществ данного класса и во многом определяет его химические свойства.
В понятие «физические свойства» входит агрегатное состояние веществ. Гомологический ряд альдегидов начинается с двух газообразных при комнатной температуре веществ, а среди одноатомных спиртов и карбоновых кислот газов нет. Учитель спрашивает класс, с чем это связано? Молекулы спиртов и кислот дополнительно связаны друг с другом водородными связями. Определение водородной связи довольно путаное, в разных учебниках трактуется по-разному и плохо запоминается учащимися. Учитель просит ребят сформулировать это определение, корректирует его и при необходимости диктует для записи:
Химическая связь между электронодефицитным атомом водорода и электроноизбыточным атомом элемента с большой электроотрицательностью (F, О, N) называется водородной.
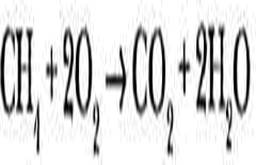
Химические свойства каждого класса веществ были подробно рассмотрены на соответствующих уроках. Для обобщения этого материала в профильных классах мы предлагаем проанализировать влияние природы функциональной группы на кислотные свойства вещества.
Учитель просит учащихся расположить фенол, этанол, уксусную кислоту и этаналь в порядке увеличения кислотных свойств. Нужный ряд выстраивается обычно без особых усилий:
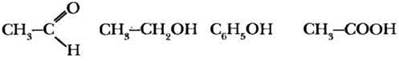
Почему альдегид оказался в этом ряду первым, демонстрируя отсутствие кислотных свойств? Кислотой (по Бренстеду) является вещество, способное к отщеплению катиона водорода. В альдегиде все атомы водорода связаны с углеродом. Связь С—H очень мало полярна, ее гетеролитический разрыв требует большой затраты энергии. Кроме того, анион с отрицательным зарядом на углероде не устойчив. Остальные три вещества проявляют кислотные свойства за счет гидроксильной группы —ОН. Легкость отрыва катиона водорода определяется величиной и знаком индуктивного эффекта заместителя, связанного с гидроксилом. Алкильный заместитель в спиртах обладает +I-эффектом, он уменьшает поляризацию связи О—H. Группа атомов СН3—С=O (она называется ацетил), напротив, обедняет гидроксильную группу электронной плотностью, это облегчает гетеролитический разрыв связи О—Н. Фенильный радикал по своему влиянию на полярность связи в гидроксиле занимает промежуточное положение между алкильным и ацильным заместителем.
Поскольку вопросы сравнения кислотных свойств кислородсодержащих соединений включены в итоговую контрольную работу, учитель должен закрепить этот материал на уроке или в форме домашнего задания.
Задание
Расположите вещества в порядке усиления кислотных свойств. Поясните свой выбор.
1-й уровень
![]()
2-й уровень
Этанол, 2,4,6-тринитрофенол, вода, фенол.