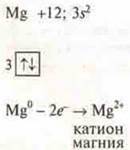Поурочные разработки по химии 11 класс
Урок-семинар на тему «Виды химической связи, типы кристаллических решеток» - СТРОЕНИЕ ВЕЩЕСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: обобщить, закрепить знание учащимися темы и умение применять их в решении упражнений.
Оборудование: таблицы «Виды химической связи», «Типы кристаллических решеток», кристаллические решетки (модели): ионная, атомная, молекулярная; кодотранспорант с вопросами теории и практики.
Ход урока
I. Организационный момент
Постановка целей и задач урока, организация учащихся на проведение семинара. Вопросы теории обсуждаются согласно их последовательности, используются конспекты, текст учебника, наглядные пособия.
II. Обсуждение вопросов теории и практики
Теоретическая часть
1. Понятия «химическая связь», «электроотрицательность».
2. Ионная связь. Определение. Примеры соединений. Механизм образования ионной связи. Тип кристаллической решетки, физические свойства веществ с ионной связью.
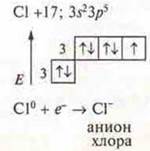
3. Ковалентная связь. Определение. Примеры соединений. Виды ковалентной связи. Механизмы образования ковалентной связи:
а) обменный;
б) донорно-акцепторный;
Типы кристаллических решеток, физические свойства веществ.
4. Металлическая связь. Определение. Пример. Механизмы образования. Тип кристаллической решетки. Физические свойства. Сходство и различия с ковалентной и ионной связью.
5. Водородная связь. Определение. Примеры соединений. Механизмы образования водородной связи. Тип кристаллической решетки. Физические свойства веществ.
6. В чем заключается единство природы всех видов химической связи? На конкретных примерах объяснить переход одного вида связи в другой. Далее приступаем к обсуждению вопросов практики, которые непосредственно являются домашним заданием.
Практическая часть
1. Какие виды химической связи и типы кристаллических решеток характерны для соединений?
N2; Са; CaF2; F2; OF2; К2O2; Na2SO4.
2. Объяснить механизм образования связи в соединениях.
a) N2; б) Са; в) OF2; г) CaF2.
II. Самостоятельная работа
|
Вариант I |
Вариант II |
|
1. Дать характеристику соединений по плану: вид связи, определение, механизм образования связи, способ перекрывания орбиталей, тип кристаллической решетки, физические свойства. |
|
|
а) NF3
б) MgCl2 |
a) H2S б) Сl2 |
|
2. Возникает ли в соединении водородная связь и какая именно? |
|
|
HF |
NH3 |
|
Почему они растворяются в воде? |
|
III. Подведение итогов урока
IV. Домашнее задание
Повторить: валентные состояния атома углерода в органических соединениях; гибридизация –sp3; -sp2: -sp, записи за 10 класс, учебник для 10 класса.
Ответы на вопросы теории предложены в планах-конспектах уроков № 1, 2, учебник § 6.
Ответы
Практическая часть
1. Ионная связь — CaF2; ионная кристаллическая решетка. Ковалентная неполярная связь — N2; F2; молекулярная кристаллическая решетка.
Ковалентная полярная связь — OF2; молекулярная кристаллическая решетка.
Са — металлическая связь, металлическая решетка.
К2O2 — в соединении ионная связь и ковалентная неполярная; ионная кристаллическая решетка.
Na2SO4 — в соединении ионная связь; ковалентная полярная, в анионе SO42 — ионная кристаллическая решетка.
2. Механизм образования связи в соединениях:
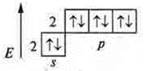
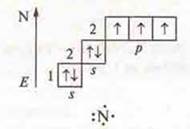
a) N2 — ковалентная, неполярная связь.
+7; 1s22s22p3
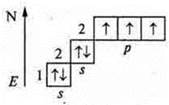
![]() — атом азота имеет пару спаренных электронов и три неспаренных по обменному механизму с другим атомом азота идет образование трех общих электронных пар, идет перекрывание р-орбиталей, одно осевое — σ-связь и два боковых перекрывания 2π-связи.
— атом азота имеет пару спаренных электронов и три неспаренных по обменному механизму с другим атомом азота идет образование трех общих электронных пар, идет перекрывание р-орбиталей, одно осевое — σ-связь и два боковых перекрывания 2π-связи.
![]() Кратность связи — 3.
Кратность связи — 3.
Кристаллическая решетка — молекулярная.
б) Са — металл, металлическая связь, в кристалле присутствуют атомы-ионы, свободные электроны; за счет их взаимопритяжения осуществляется связь.
в) OF2 — ковалентная полярная связь.
+8; 1s22s22p4
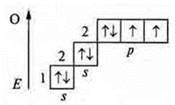
![]() — атом кислорода имеет две пары спаренных электронов и 2p-неспаренных электрона.
— атом кислорода имеет две пары спаренных электронов и 2p-неспаренных электрона.
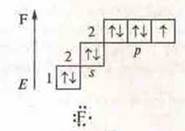
-9; 1s22s22p5
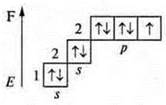
![]() — атом фтора имеет три пары спаренных электронов и 1 р-неспаренный электрон.
— атом фтора имеет три пары спаренных электронов и 1 р-неспаренный электрон.
Между атомом кислорода и двумя атомами фтора образуются общие электронные пары по обменному механизму, т. к. ЭО фтора больше ЭО кислорода, общие электронные пары смещены в сторону атомов фтора.
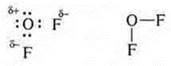
г) CaF2 — ионная связь соединения образована элементами, резко отличающиеся в ЭО.
|
Са — металл |
F — неметалл |
|
Са 4s2 |
F +8; 2s22p5 |
|
|
|
|
отдает 2е- атомам фтора |
|
|
|
|
|
приобретает заряд +2 |
атом фтора принимает один электрон, приобретает заряд -1. |
Взаимопритяжение противоположно заряженных частиц приводит к образованию соединения с ионной связью.
![]()
Самостоятельная работа
Вариант I
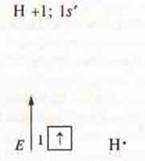
1. a) NF3 — ковалентная полярная связь. Связь посредством общих электронных пар, образованных по обменному механизму
|
N +7; 1s22s22р3 |
F +9; 1s22s22p5 |
|
три неспаренных р-электрона |
один неспаренный p-электрон, необходимо три атома фтора |

Перекрывание орбиталей осевое, образуются σ-связи; кратность связи между атомами — 1.
Кристаллическая решетка молекулярная, возможно, что это газ, легко переходящий в жидкость.
б) MgCl2 — ионная связь, связь за счет электростатического притяжения противоположно заряженных частиц. Соединение образовано металлом и неметаллом, которые резко отличаются в ЭО.
|
|
|
Взаимопритяжение противоположно заряженных частиц приводит к образованию соединения с ионной связью:
![]()
Ионная кристаллическая решетка, вещество твердое, тугоплавкое.
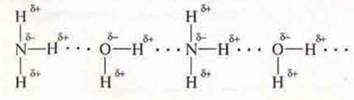
2. HF — соединения с полярной ковалентной связью в молекуле есть смещение общей электронной пары к ЭО атому фтора и возникает полюсность. δ+ — у атома водорода и δ- — у атома фтора, фтор также имеет неподеленные пары электронов Между молекулами возможно образование водородной связи.
![]()
Так как в молекуле воды также наблюдается смещение общих элек тронных пар к ЭО атома О — кислороду, который также имеет неподеленные пары электронов. В молекуле у атомов водорода возникает недостаток электронной плотности δ+, у атома кислорода — избыток δ-.
Между молекулами фтороводорода и воды возможно образование водородных связей, фтороводород растворим в воде.
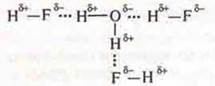
Вариант II
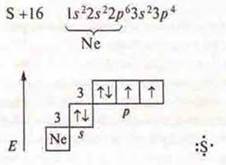
1. a) H2S — ковалентная полярная связь, связь посредством общих электронных пар, образованных по обменному механизму.
|
один неспаренный s-электрон |
на третьем энергетическом уровне две пары спаренных электронов и 2р-неспаренных электрона |
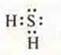
Идет перекрывание s-орбиталей атомов водородов и p-орбиталей атома серы, перекрывание осевое, образуется σ-связь, смешенная в сторону ЭО атома серы, кратность связи — 1; кристаллическая решетка молекулярная.
б) Сl2 — ковалентная неполярная связь, связь посредством обшей электронной пары, образованной по обменному механизму.
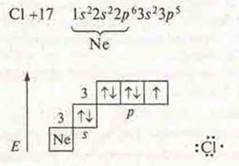
В атоме три пары спаренных электрона и один р-электрон, не спаренный. Происходит перекрывание p-орбиталей, осевое, возникает σ-связь.
![]()
Кратность связи — 1. Кристаллическая решетка молекулярная.
2. NH3 — соединение с полярной ковалентной связью, в молекуле есть смещение общих электронных пар к ЭО атому азота, у которого есть неподеленная пара электрона, возникает полюсность: δ+ — у атомов водорода, δ- — у атома азота.
Между молекулами возможно возникновение водородных связей.
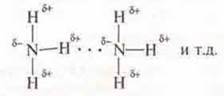
Так как в молекуле воды также наблюдается смешение общих электронных пар к ЭО атому — кислороду, который также имеет неподеленные пары электронов. В молекуле Н2O у атомов водорода возникает недостаток электронной плотности δ+. у атома кислорода — избыток δ+. Между молекулами NH3 и Н2O возможно образование водородных связей. NH3 растворим в воде.