Поурочные разработки по химии 11 класс
Урок-лекция по теме «Гибридизация атомных орбиталей. Геометрия молекул» - СТРОЕНИЕ ВЕЩЕСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: обобщить и систематизировать знания о типах гибридизации атомных орбиталей в органических соединениях; научить применять данные знания для объяснения гибридизации в неорганических соединениях, закрепить знания зависимости геометрии молекул частицы от типа гибридизации.
Оборудование: таблицы «Строение атома углерода», «Строение метана, этана, этина», кодотранспоранты.
Основные понятия: гибридизация, типы гибридизации, геометрия молекул, частиц; алгоритмы определения типа гибридизации и геометрии частиц молекул.
Ход урока
I. Организационный момент
Учитель сообщает учащимся результат предыдущей самостоятельной работы, анализирует допущенные в заданиях ошибки, объясняет правильность их выполнения. Затем идет плавный переход к новой теме.
II. Изучение нового материала
Мы изучили основные виды химической связи, типы кристаллических решеток. Поставим перед собой такую задачу, каким же образом в молекулах многих соединений полярная ковалентная связь, а сама молекула неполярна. Например СO2, дипольный момент равен 0, а связи в пространстве расположены под углом 180 °, почему в молекуле воды дипольный момент — 6,1 · 10-30 и связи расположены в пространстве под определенным углом — 104,5 °; в молекуле СН4 — метан, ковалентная полярная связь, а сама молекула неполярна.
Оказывается, одна из причин — это гибридизация атомных орбиталей и образование валентного угла при определенном типе гибридизации.
Понятие «гибридизация» мы ввели в курсе «Органическая химия» в 10 классе при изучении валентных состояний атома углерода.
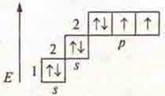
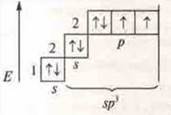
Что такое гибридизация? Выравнивание электронной плотности атомных орбиталей по энергии и по форме. АО становятся одинаковыми, вследствие чего образуются равноценные связи с другими атомами и достигается их максимальное удаление друг от друга в пространстве. У атома углерода возможны три типа гибридизации: sp3-; sp2-; sp-. К гибридизации наибольшую склонность имеют элементы II периода. Для определения типа гибридизации воспользуемся алгоритмом (на кодотранспоранте).
Алгоритм определения типа гибридизации и геометрии молекулы или частицы
|
Последовательные действия определения типа гибридизации |
Пример |
|
1) Определение С.О. элементов в соединении. С.О. элемента соответствует количеству неспаренных электронов в центральном атоме |
H2+1O-2 С.O(O) = -2 ⇒ в атоме 0 два неспаренных электрона |
|
2) Определение координационного числа центрального атома (сколько других атомов удерживает около себя). Координационное число соответствует количеству σ-связи |
к.ч.(О) = 2 в молекуле 2σ-связи O +8; 1s22s22p4 |
|
3) Построение графической формулы центрального атома |
|
|
4) На этой модели отделяем столько орбиталей с неспаренными электронами, а также свободных атомных орбиталей, сколько σ-связей. Отдеделяем начиная с s-орбитали и определяем тип гибридизации |
в гибридизации участвуют орбитали II энергетического уровня s- (пара спаренных электронов) и 3р- (одна пара спаренных электронов и два неспаренных) |
|
5) На основании типа гибридизации располагаем все гибридные орбитали в пространстве симметрично относительно ядра атома:
|
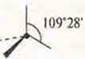
sp3-гибридизация 109°28'; 4-гибридные орбитали
|
|
6) Определяем геометрию молекулы, частицы sp3-гибридизация: 4σ-связи — тетраэдр; 3σ-связи — тригональная пирамида; 2σ-связи — угловая: 1σ-связь — линейная; sp2-гибридизация: 3σ-связи — треугольная плоская; 2σ-связи — угловая; 1σ-связь — линейная: sp-гибридизация: σ-связь — линейная |
На данной схеме четко выделяем столько направлений гибридных орбиталей, сколько a-связей, т. к. в молекуле 2σ-связи, выделяем две орбитали
Однако угол связи равен 104,5°, а не 109°28'. т.к, атом кислорода имеет две пары спаренных электронов на гибридных орбиталях, вследствие чего имеет повышенную электронную плотность, которая уменьшает угол гибридизации до 104,5° |
Следует помнить, что σ-связь всегда имеет направление в пространстве, локализованная; л-связь не имеет направления в пространстве, ни локализованная связь. Итак, мы выяснили: как определить тип гибридизации и геометрию частицы или молекулы согласно алгоритма; в гибридизации участвуют орбитали s-, р- и d-орбитали.
III. Домашнее задание
§ 7 № 3 — определить геометрию и гибридизацию по алгоритму, № 4 — объяснить выводы на основе гибридизации и геометрии молекул; повторить § 6, подготовиться к уроку обобщающего повторения.
IV. Закрепление
Задание; определить тип гибридизации и геометрию молекул:
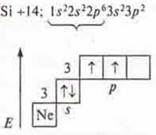
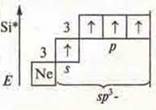
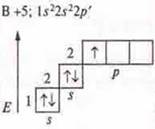
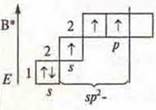
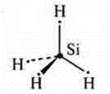
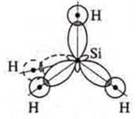
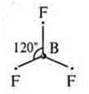
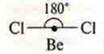
a) SiCl4; б) BF3; в) ВеСl2;
Составить в виде таблицы.
|
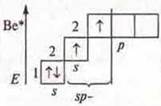
В атоме только два неспаренных электрона, а необходимо четыре, в атоме происходит распаривание 2s-электронов
В возбужденном состоянии — четыре неспаренных электрона, т. к. 4 σ-связи; отделяем четыре орбитали, sp3-гибридизация, угол 109°28'; четыре гибридные орбитали, т.к. 4σ-связи |
Один неспаренный электрон, а необходимо три. В атоме бора происходит распаривание 2s электронов
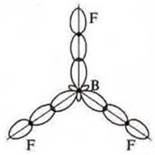
Бор в возбужденном состоянии — три неспаренных электрона, т. к. 3σ-связи: отделяем три орбитали. sp2-гибридизация; три гибридные орбитали, угол 120° |
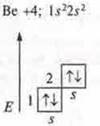
Нет неспаренных электронов, а необходимо два, идет распаривание 2s электронов
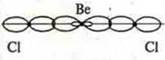
В возбужденном состоянии в атоме бора два неспаренных электрона, отделяем две орбитали, т. к. 2σ- связи, образуются две гибридные орбитали, угол 180° |
|
Геометрия молекул
тетраэдрическая форма молекул
|
Геометрия молекул
плоский треугольник
|
Геометрия молекул
линейная
|
 при sp3-гибридизации (4 гибридные орбитали 109°28’)
при sp3-гибридизации (4 гибридные орбитали 109°28’) при sp2-гибридизации (три гибридные орбитали 120°)
при sp2-гибридизации (три гибридные орбитали 120°)
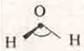 угловая форма молекулы
угловая форма молекулы