Поурочные разработки по химии 11 класс
Урок обобщающего повторения по теме «Гибридизация атомных орбиталей. Геометрия молекул, частиц» - СТРОЕНИЕ ВЕЩЕСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цель урока: закрепить знания определений типа химической связи, типа гибридизации геометрии молекул, частицы по алгоритму, умение определять гибридизацию в соединениях неорганической химии более сложного строения.
Оборудование: текст § 7 учебника, таблицы гибридизации, конспекты теории в рабочих тетрадях.
Ход урока
I. Организационный момент
Ознакомить учащихся с планом работы на уроке, его целями и задачами.
Урок состоит из следующих этапов.
1) Работа у доски.
Дать монологический ответ, выполняя домашнее задание № 3 и 4 (два ученика) о типах гибридизации и геометрии молекул, частиц.
2) В момент подготовки учащихся к монологическому ответу, учащиеся класса работают по заданию:
а) Работа учащихся класса. Определить тип химической связи в следующих соединениях, дать обоснованный ответ.
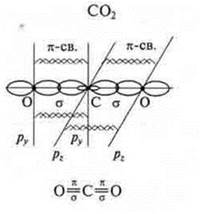
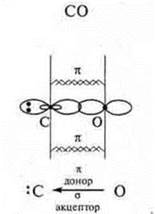
СО2; К2; NaCl; Mg; H2S; CCl4; СО;
б) В соединениях СO2 и СО определить тип гибридизации и геометрию молекул.
3) Если учащиеся готовы с ответом у доски, то необходимо их выслушать, а затем проверить работу, выполненную учащимися класса. В качестве контроля учитель предлагает на кодотранспортере правильно выполненные задания.
Учащиеся самостоятельно сверяют, определяют свои ошибки, исправляют ответы на вопросы.
Как правило, учитель контролирует их работу, делает акценты на главные моменты выполнения заданий, так как следующим этапом работы будет небольшая самостоятельная работа.
Определить тип гибридизации и геометрию молекул по алгоритму
OF2 NH3
Учитель подводит итог обобщающего урока и предлагает усложненное домашнее задание. Определить тип гибридизации и геометрию
ClF3; SCl4; (CO3)2-
II. Примерные монологические ответы учащихся у доски
Задание № 3 § 7
|
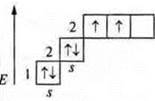
Один неспаренный p-электрон, а необходимо три. В атоме происходит распаривание:
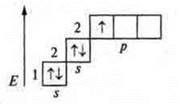
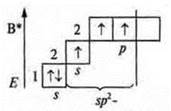
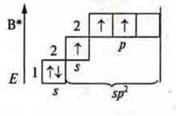
Три неспаренных электрона, 1s-электрон и 2p-электрона. sp2-гибридизация: три гибридных орбитали; угол 120°.
|
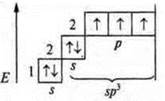
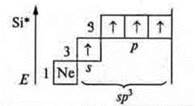
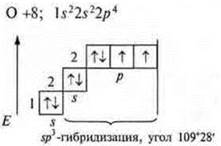
В атоме три неспаренных электрона, в гибридизацию вступают пара спаренных электронов 2s и три неспаренных p-электрона; sр3-гибридизация. Четыре гибридных орбитали. Направление в пространстве 109°28':
На этой модели отмечаем три сигма связи:
|
|
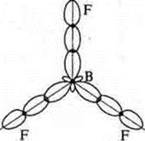
Геометрия молекулы — плоский треугольник:
F +9: 1s22s22p5
1 p-электрон |
F +9; 1s22s22p5
1 неспаренный p-электрон
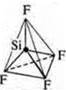
Тригональная пирамида; угол 107°, уменьшается за счет действия повышенной плотности атома азота, имеющего неподеленную пару электронов |
Задание № 4 § 7
|
Тетраэдрическое строение.
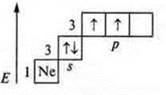
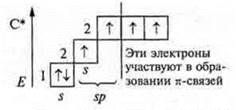
Необходимо 4 неспаренных е-, а их только два, возбуждение и распаривание 3s2
Гибридизация sp3; участвуют одна s-орбиталь и три р-орбитали, четыре гибридные орбитали угол 109°28', так как 4 σ-связи, то форма молекул тетраэдрическая
|
Плоский треугольник.
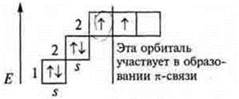
Один неспаренный электрон, а необходимо три, происходит распаривание 2s-электронов
Три неспаренных электрона, в гибридизации участвуют одна s-орбиталь и 2р-орбитали. sp2-гибридизация, угол 120°
плоский треугольник |
III. Работа учащихся класса
1) Металлическая связь — Mg; простое вещество — металл.
Ионная связь — NaCl; соединение образовано металлом Na, неметаллом Сl, которые резко отличаются в ЭО.
Коваленткая полярная связь — ССl4; H2S; СO2; СО.
Соединения образованы атомами неметаллов, которые отличаются в ЭО не резко.
|
С +6; 1s22s22p2
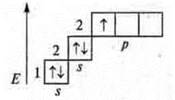
Два неспаренных электрона, а необходимо — четыре, идет распаривание двух s-электронов
В гибридизации участвуют две орбитали s- и p-, так как 2σ-связи; sр-гибридизация, 180°
линейная форма молекулы |
С +6; 1s22s22p2
Один неспаренный электрон, а необходимо три, происходит распаривание 2s-электронов
В гибридизацию вступают 2s-орбиталь и 2р-орбиталь; sp- гибридизация
линейная форма молекулы |
Если позволяет время урока, учитель помогает учащимся нарисовать перекрывание орбиталей.
|
|
1 σ-связь; 1 π-связь одна связь по донорно-акцепторному механизму |
IV. Самостоятельная работа
Вариант I
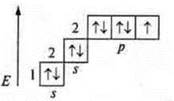
![]() 2 неспаренных электрона в атоме;
2 неспаренных электрона в атоме;
![]() 2σ-связи в молекуле.
2σ-связи в молекуле.
 В гибридизации участвуют орбитали s- и р-.
В гибридизации участвуют орбитали s- и р-.
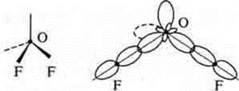 Выделяем две связи: угловая форма молекулы
Выделяем две связи: угловая форма молекулы
Вариант II
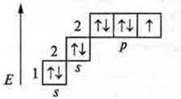
![]() три неспаренных электрона в атоме;
три неспаренных электрона в атоме;
![]() 3 σ-связи в молекуле.
3 σ-связи в молекуле.
![]()
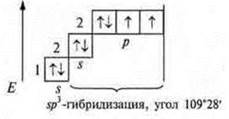 В гибридизации участвуют s- и р-орбитали; sp3-гибридизация, угол 109°28’ четыре гибридные орбитали.
В гибридизации участвуют s- и р-орбитали; sp3-гибридизация, угол 109°28’ четыре гибридные орбитали.
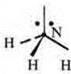 Выделяем три связи.
Выделяем три связи.
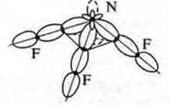
Тригональная пирамида в атоме азота в вершине пирамиды, угол гибридизации изменяется за счет пары электронов азота и становится 107°.
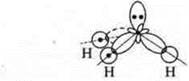
Перекрывание орбиталей