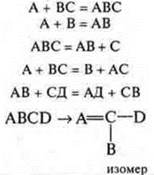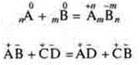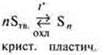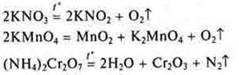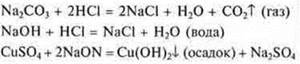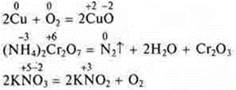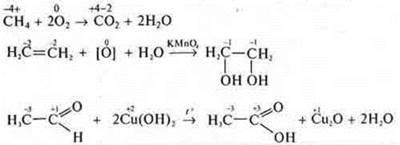Поурочные разработки по химии 11 класс
Классификация химических реакций в органической и неорганической химии - ХИМИЧЕСКИЕ РЕАКЦИИ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: обобщить представления о химической реакции как о процессе превращения одного или нескольких веществ в вещество, отличающееся от них по химическому строению и свойствам; ввести признаки классификации химических реакций и научить применять их в характеристике химических реакций неорганической и органической химии, показать относительный характер различных типов химических реакций и взаимосвязь различных классификаций химических процессов.
Основные понятия: реакция, химическая реакция, типы химических реакций — реакция соединения, реакция разложения, реакция обмена, реакция замещения, окислительно-восстановительные реакции, экзотермические и эндотермические реакции, обратимые и необратимые реакции, гомогенные и гетерогенные реакции, каталитические и не каталитические реакции.
Оборудование: кодотранспоранты. Mg; СаО; CuSO4; Na; фенол, уксусная кислота; NaOH; раствор l2; KNO3 (тв.); Na2CO3; НСl; фенол, фосфор красный, ложечка для сжигания, колбы, пробирки, вода, индикатор, основная соль меди, КМnO4, лучинка, (NH4)2Cr2O7; сырой картофель, мясо свежее, Н2O2.
Ход урока
I. Организационный момент
Учитель анализирует результаты контрольной работы. Акцентирует внимание учащихся на типичные ошибки. Предлагается учащимся выполнить работу над ошибками по дополнительным заданиям.
Далее учащиеся знакомятся со следующей темой изучения, основными узловыми моментами; учащимся сообщаются виды контроля усвоения темы: тест, самостоятельные работы, практические работы, контрольные работы.
В тетрадях учащиеся записывают общую тему изучения и тему урока, план изучения.
План изучения
1. Реакция, химическая реакция. Определение.
2. Признаки классификации химических реакций, типы химических реакций (опорный конспект на кодотранспоранте или напечатанный на отдельном листке, на каждый стол). Проведение экспериментов, подтверждающих тип реакции.
3. Характеристика химической реакции (согласно классификации).
Термин «реакция» в переводе с латинского означает «противодействие», «отпор», «ответное действие».
«Химическая реакция» понимается как ответное действие вещества на воздействие на него извне других веществ, учитывая факторы — температуру, свет, электрический ток, излучение, механическое воздействие. Однако под действием этих факторов происходят и физические процессы: плавление, замерзание, кипение, испарение. Следовательно,
Химическая реакция — это такое изменение веществ, при которых разрушаются старые и образуются новые химические связи между частицами (атомами, ионами) из которых построены вещества.
Пример. ![]()
При химических реакциях в отличие от ядерных реакций, не изменяется общее число атомов или ионов в реагирующей системе, а также изотопный состав химических элементов.
Пример:
а) ядерная реакция
![]() (изотоп кислорода);
(изотоп кислорода);
б) синтез трансурановых элементов.
Далее идет беседа учителя с учащимися.
Вопрос: Какие же типы химических реакций известны нам из курса неорганической и органической химии
Ответ: Известные типы химических реакций в неорганической химии:
реакции соединения А + ВС = ABC, А + В = АВ;
реакции разложения ABC = А + В + С, ABC = АВ + С;
реакции замещения А + ВС = В + АС;
реакции обмена АВ + СД = СВ + АД,
где А, В, С — простые вещества, АВ, СД, ABC — сложные вещества.
В органической химии были известны реакции присоединения по π-связи; реакции замещения; реакции полимеризации и т. д. Однако есть и признаки, по которым можно более правильно дать классификацию химических реакций.
Учащимся предлагается кодотранспорант.
Классификация химических реакций по определенным признакам
|
Признак |
Химические реакции |
Общий вид |
|
1. Число и состав реагирующих веществ и продуктов реакции: 1) с изменением состава веществ 2) без изменения состава веществ |
а) реакции соединения б) реакция разложения в) реакция замещения г) реакция обмена д) реакция изомеризации |
|
|
2. Изменение С.О. элементов, входящих в состав реагирующих веществ и образовавшихся соединений: 1) с изменением С.О. 2) без изменения С.О. |
окислительно-восстановительные реакции реакции не являются ОВР |
|
|
3. Тепловой эффект |
а) экзотермические б) эндотермические |
А + В = CD + Q А + В = CD - Q |
|
4. Агрегатное состояние реагирующих и образовавшихся веществ |
а) гомогенные б) гетерогенные |
все вещества одного агрегатного состояния вещества разных агрегатных состояний |
|
5. Использование катализатора |
а) каталитические б) некаталитические |
|
|
6. Направление реакции |
а) обратимые реакции б) необратимые реакции |
|
В последовательности классификации учащиеся, работая с текстом учебника, наблюдая за экспериментами, которые осуществляет учитель, в тетрадях составляют таблицу.
Первый признак классификации: по числу и составу реагирующих вещества
|
Классификация |
Тип реакции |
Определение типа |
Пример реакции |
|
1) Реакция без изменения состава веществ |
Реакция изомеризации |
В ходе химической реакции изменяется структура (химическое строение, а не состав вещества) |
Демонстрация получения пластической серы:
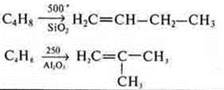
Углеводороды — органические соединения в зависимости от условий:
|
|
2) Реакции с изменением состава веществ |
а) Реакция соединения А + В = АВ АВ +CD = ABCD |
Химические реакции, в результате которых из двух или нескольких простых или сложных веществ образуют одно сложное вещество |
Эксперимент горения серы: S + O2 = SO2 Взаимодействие двухсложных веществ: СаО + Н2O = Са(ОН)2 Эксперимент:
|
|
|
В органической химии химические реакции называются в зависимости от того, что присоединяется |
Гидрирование (+Н2):
Реакция гидратации (+ Н2O):
Реакция галогенирования (+ галоген):
Реакция гилрогалогенирования (+ галогено-водород)
Реакция полимеризации
|
|
|
б) Реакции разложения: ABCD = АВ + С + D ABCD = АВ + CD АВ = А + В |
Это реакции, при которых из одного сложного вещества образуется несколько новых веществ — простых и сложных. В органической химии реакции разложения называются реакции элиминирования. Это реакции, обратные реакциям присоединения, с приставкой де-: |
Разложение KNO3 при t°.
+ H2 — реакция гидрирования; + Н2O — реакция гидратации; = Н2 + — реакция дегидрирования; → Н2O + —реакция дегидратации:
+ галоген → — реакция галогенирования; → галоген + — реакция дегалогенирования:
+ Н галоген → — реакция гидрогалогенирования; → Н галоген + — реакция дегидрогалогенирования. |
|
|
в) Реакции замещения А + ВС = АВ + С |
Реакции, в результате которых атомы простого вещества замещают атомы другого элемента и образуют новое простое вещество и новое сложное вещество |
В неорганической химии:
В органической химии:
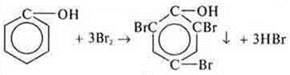
Реакция бромирования:
Реакция нитрования; реакция хлорирования. Некоторые реакции замещения в органической химии выглядят как реакции обмена:
|
|
|
г) Реакции обмена АВ + CD = AD + СВ |
Химические реакции, при которых два сложных вещества обмениваются своими составными частями |
В неорганической химии:
В органической химии:
|
Второй признак классификации: по изменению степеней окисления химических элементов, образующих вещества
|
Тип реакции |
Определение типа |
Пример реакции |
|
1) Происходит изменение С.О. |
Это окислительно-восстановительные реакции |
В неорганической химии, как правило, это реакция соединения, разложения:
В органической химии многие реакции можно рассматривать как реакции ОВР:
|
|
2) С.О. не изменяется |
Реакции не являются окислительно-восстановительными |
|
|
1) Экзотермические реакции |
Реакции, в результате которых выделяется тепло. Как правило, реакции горения, многие реакции соединения, в органической химии реакции гидрирования, галогенирования |
|
|
2) Эндотермические реакции |
Реакции, в результате которых тепло поглощается |
В неорганической химии некоторые реакции соединения:
Реакция разложения: В органической химии — реакция элиминирования:
|
Четвертый признак классификации: по агрегатному состоянию
|
Тип реакции |
Определение типа |
Пример реакции |
|
1) Гетерогенные реакции |
Реакции, в которых реагирующие вещества и продукт реакции находятся в различных агрегатных состояниях (в разных фазах) |
|
|
2) Гомогенные реакции |
Реакции, в которых реагирующие вещества и продукты реакции находятся в одинаковых агрегатных состояниях (в одной фазе) |
|
Пятый признак классификации: по участию катализатора
|
Тип реакции |
Определение типа |
Пример реакции |
|
1) Реакции каталитические 2) Реакции некаталитические |
Реакции, которые идут с участием катализатора Реакции без участия катализатора |
[кусочек мяса] + Н2O2 → выделение O2↑ [сырой картофель] + H2О2 → выделение O2↑ (эксперимент) 2Mg + O2 = 2MgO |
Шестой признак классификации: по направлению
|
Тип реакции |
Определение типа |
Пример реакции |
|
1) Обратимые реакции 2) Необратимые реакции |
Реакции, которые в данных условиях протекают одновременно «двух противоположных направлениях Реакции, которые в данных условиях протекают только водном направлении |
В органической химии: реакция гидрирования — реакция дегидрирования; реакция гидратации — реакция дегидратации; реакция полимеризации — реакция деполимеризации; реакция этерификации, реакция гидролиза белков, углеводов, полинуклеопедов, жиров. В неорганической химии большинство реакции — это обратимые реакции:
В неорганической химии — реакции обмена, сопровождающиеся выпадением осадка, образования воды, выделением газа или очень слабого электролита, и все реакции горения |
II. Домашнее задание
§ 11, № 1, 3, 6 (№ 1, 6 — требуют такой же характеристики уравнений).
III. Закрепление
Характеристика химического уравнения по признакам классификации.
![]()
1) реакции с изменением состава вещества;
2) АВ = А + В; реакция разложения, т. к. из одного сложного вещества образовалось два новых простых;
3) реакция ОВР
![]()
элементы изменили С.О.
4) реакция эндотермическая — по тепловому эффекту;
5) реакция гетерогенная по фазе;
6) реакция необратимая.