Поурочные разработки по химии 11 класс
Факторы, влияющие на скорость химических реакций - ХИМИЧЕСКИЕ РЕАКЦИИ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: научить объяснять влияние различных факторов на скорость химических реакций на основании понятия энергии активации; решать расчетные задачи данной темы.
Основные понятия: константа скорости, закон действующих масс, температурный коэффициент, катализатор, катализ: гомогенный и гетерогенный.
Оборудование: реактивы для демонстрации опытов: a) Na2SO4 и ВаСl2; б) Mg и HCl; Zn и НСl; в) Na и Н2O; Na и спирт; г) Mg и НСl: д) Mg и CH3COOH; е) HCl, Zn (гранул.), Zn (порошок); ж) H2SO4 (р), тиосульфат натрия; S и O2; СаСO3 (кусочек мела), СаСO3 (измельчен.); з) сырой картофель, вареный (или мясо), спирт, кусочек сахара, пепел.
Ход урока
I. Фронтальный опрос
1. Дать определение скорости гомогенной реакции. Формула скорости гомогенной реакции.
2. Дать определение скорости гетерогенной реакции. Формула скорости гетерогенной реакции.
3. Что такое энергия активации (Еа)? Почему важно знать Еа веществ?
4. Расчетная задача:
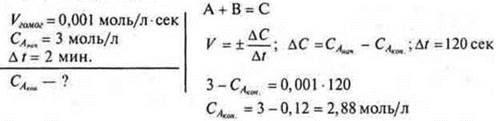
Ответ: СА ком = 2,88 моль/л
II. Изучение нового материала
План изложения
1. Факторы, влияющие на скорость химической реакции.
а) природа реагирующих веществ,
б) концентрации реагирующих веществ: давление (для газов)
в) поверхность соприкосновения реагирующих веществ.
г) температура.
д) катализатор, ингибиторы.
2. Решение расчетных задач.
Скорость химической реакции зависит от многих факторов. Основными из них являются природа и концентрации реагирующих веществ, давление — если в реакции участвуют газообразные вещества, поверхность соприкосновения реагирующих веществ, температура, действие катализатора.
Нам необходимо рассмотреть влияние каждого из этих факторов на скорость химической реакции, подтвердив экспериментально.
Первый фактор — природа реагирующих веществ и энергия активации взаимосвязаны. Если Еа иона 40 кДж/моль, это означает то, что большинство столкновений частиц приводит к их быстрому взаимодействию. Реакции ионного обмена протекают мгновенно, скорость таких реакций очень большая, т. к. в реакциях участвуют анионы и катионы, у которых Еа очень мала.
Если Еа очень велика, > 120 кДж/моль, это означает то, что лишь малое число столкновений взаимодействующих частиц приводит к образованию новых веществ. Скорость такой реакции очень мала. Например, взаимодействие азота с водородом с образованием аммиака при обычных условиях невозможно. Если Еа имеет промежуточное значение 40 < Еа < 120, скорость таких реакций имеет среднее значение. Примеры таких реакций — взаимодействие металлов с кислотами, гидролиз сахарозы, взаимодействие натрия с водой, спиртом и т. д.
Таким образом, под природой реагирующих веществ следует понимать:
а) Особенности строения атомов элементов металлов и неметаллов.
Пример. К активнее Na; Mg активнее Zn, т. к. радиусы атомов разные, восстановительная способность разная, отличаются Еа.
Сравнительный эксперимент взаимодействия К и Na с водой:
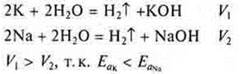
Взаимодействие Mg и Zn с соляной кислотой:
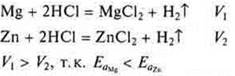
б) Особенности химической связи: виды связи; σ- или π-связи; кратность связи, длина связи.
Пример. В молекуле азота N2 — ковалентная неполярная связь, кратность связи — три; одна σ-связь и 2π-связи, связь короткая; Еа N2 очень высока.
В соединениях с ионной связью для ионов Еа очень мала. Реакции идут мгновенно.
Опыт: ![]()
![]() — выпадает осадок белого цвета мгновенно.
— выпадает осадок белого цвета мгновенно.
в) Велико значение в соединениях взаимного влияния атомов и групп атомов. В молекуле этанола на подвижность водорода в группе —ОН оказывает влияние углеводородный радикал, что замедляет скорость реакции, если сравнить взаимодействие натрия в водой и натрия со спиртом.
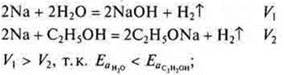
г) Если участвуют электроны, то и сила электролита сказывается на скорости реакции. Сравнить скорость реакции магния с соляной кислотой — сильная кислота и магния с уксусной кислотой — слабая кислота.
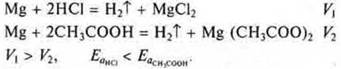
Второй фактор — концентрации реагирующих веществ. Чтобы осуществилось химическое взаимодействие между какими-то частицами, они должны эффективно столкнуться. Чем больше концентрация реагирующих веществ, тем больше столкновений и, соответственно, выше скорость реакции. На основании экспериментов, проведенных в 1867 г. норвежцами К. Гульдбергом и П. Вааге и независимо от них в 1865 г. русским ученым Н. И. Бекетовым, был сформирован основной закон химической кинетики и установлена зависимость скорости реакции от концентрации реагирующих веществ.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
Этот закон также называют законом действующих масс (в конце XIX века термин «концентрация» еще не был введен, а химики вместо него использовали термин «действующие массы»).
Для реакции А + В = D, вычисляется
![]()
а скорость реакции А + 2В = D определяется как
![]()
где СА, СВ— концентрации реагирующих веществ, моль/л, k1, k2 — константы скорости реакции.
Константа скорости зависит только от температуры и не зависит от концентрации веществ. Константа скорости при постоянной температуре численно равна скорости реакции, в которой концентрации реагирующих веществ равны 1 моль/л. Закон действующих масс не учитывает концентрации реагирующих веществ, находящихся в твердом состоянии, т. к. они реагируют на поверхности и их концентрации являются постоянными.
Пример: ![]()
V = k · СO2, скорость реакции пропорциональна только концентрации кислорода. Таким образом, закон действующих масс учитывает лишь концентрации газообразных или растворенных веществ.
Пример:
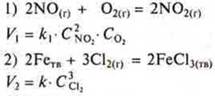
Изменение давления при участии в реакции газообразных веществ также приводит к изменению концентрации этих веществ. Так, при увеличении давления в 2, 3 и большее число раз уменьшается объем, а концентрация веществ на единицу объема увеличивается в это же число раз, и наоборот, при уменьшении давления объем увеличивается, а концентрация на единицу объема также будет уменьшаться.
Пример:
а) ![]() — без изменения давления
— без изменения давления
![]()
б) давление увеличено в 3 раза,
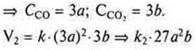
В целом скорость реакции возросла:
![]() - в 27 раз;
- в 27 раз;
в) давление уменьшили в 2 раза.
![]()
![]() - скорость реакции уменьшается в 8 раз.
- скорость реакции уменьшается в 8 раз.
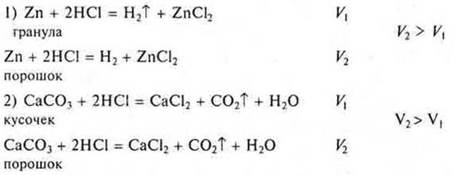
Третий фактор — поверхность соприкосновения реагирующих веществ. Реакции идут на поверхности — это гетерогенные реакции.
Формула скорости ![]() чем меньше единица площади S, тем больше скорость реакции.
чем меньше единица площади S, тем больше скорость реакции.
Твердые реагирующие вещества следует измельчать, растирать, т. е. нарушать структуру кристаллической решетки, т.к. частицы на микрокристалле реакционноспособнее, чем те же частицы на «гладкой поверхности».
Опыт. Сравнить скорости реакции (через кодоскоп)
В промышленности для проведения гетерогенных реакций используют «кипящий слой», увеличивая поверхность соприкосновения реагирующих веществ и отвод продуктов реакции. При производстве серной кислоты в «кипящем слое» проводят обжиг колчедана; в органической химии в «кипящем слое» проводят каталитический крекинг нефтепродуктов и регенерацию катализатора.
Четвертый фактор — температура.
Чем выше температура, тем больше активных частиц, т. к. повышается Еа, а также увеличивается скорость их движения, что приводит к большому числу соударений при взаимодействии друг с другом. Наблюдается увеличение скорости реакции. Реакция между кислородом и водородом при t° = 20 °С за 54 млрд. лет протекает на 15%, при 500 °С — за 50 мин, при 700 °С — мгновенно.
В 1844 г. Я. Вант-Гофф установил, что при повышении температуры на каждые 10° скорость химической реакции увеличивается в 2—4 раза. Эту величину называют температурным коэффициентом реакции, обозначается у — гамма. Для каждой реакции числом от 2 до 4. При повышении температуры с t°1 до t°2 реакция ускоряется в ![]() раз, т. е. скорость реакции при
раз, т. е. скорость реакции при ![]()
Опыт. Взаимодействие НСl с цинком при: а) обычных условиях (V1); б) при нагревании (V2). V2 > V1.
Для более точных расчетов пользуются уравнением Аррениуса:
![]()
где К — константа скорости; Z — число столкновений молекул, частиц в секунду в единице объема; Р — стереохимический множитель; е — основание натурального логарифма (е = 3,718); R— универсальная газовая постоянная (R = 8,314 Дж/мольК); Т — температура в Кельвинах (273° + t°С); Еа — энергия активации.
Однако повышение температуры не всегда применима, т. к. исходные вещества могут начать разлагаться, испаряться, растворители или сами вещества испаряются.
Опыт 1. Взаимодействие тиосульфата натрия Na2S2O3 с серной кислотой:
а) при комнатной температуре;
б) при повышении температуры на 10° выше комнатной;
в) при повышении температуры на 20° выше комнатной.
По каждому этапу определяют время помутнения, выпадения серы, замечаем ta > tб > tв.
![]()
Опыт 2. Можно показать горение серы на воздухе и в чистом кислороде. Предварительно собрать кислород в колбе (либо разложением КМnO4, либо разложением Н2O2 на катализаторе).
Яркое свечение — голубое пламя при горении серы в чистом кислороде обусловлено тем, что в этом случае скорость реакции будет больше, т. к. концентрация кислорода высокая, а в воздухе его ≈ 20 %.
Пятый фактор — катализатор, ингибитор. Катализаторы — вещества, уменьшающие механизм реакции и направление ее по энергии более выгодным путем, с меньшей энергией активации.
Катализаторы — вещества, участвующие в химической реакции и изменяющие ее скорость или направление, оставаясь на окончание реакции неизменными качественно и количественно. Если катализатор и реагенты находятся в одном агрегатном состоянии — это гомогенный катализ.
Пример.
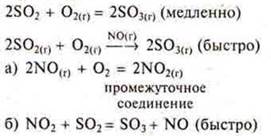
Если катализатор и реагенты находятся в разных агрегатных состояниях — это гетерогенный катализ.
![]()
Механизм действия катализатора объясняется образованием промежуточных соединений, которые легко затем вступают в химическую реакцию.
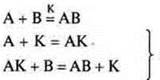 протекают с большой скоростью
протекают с большой скоростью
АК — промежуточное соединение.
В присутствии катализатора изменяется путь, по которому проходит суммарная реакция, поэтому изменяется ее скорость. Катализаторы положительные увеличивают скорость реакции.
Катализаторы отрицательные — ингибиторы — замедляют скорость химической реакции. Они реагируют с высокой скоростью с активными частицами и образуют малоактивные соединения. Скорость реакции замедляется, и химическая реакция прекращается. Ингибиторы стабилизируют кислоты при их перевозке в стальной таре, подавляют действие пероксида водорода, мономеры предотвращают преждевременную полимеризацию.
Очень эффективно работают катализаторы и ингибиторы в живом организме. Катализаторы в живом организме называются ферментами. Благодаря им в живом организме при невысокой температуре с большой скоростью протекает множество сложных реакций. Ферменты отличаются особой специфичностью, каждый из них ускоряет только одну химическую реакцию с выходом 100 %. Ингибиторы в живом организме подавляют различные вредные реакции окисления в клетках тканей, которые могут инициироваться радиоактивным излучением.
Опыт.
1) Кусочек сахара быстро загорается, если на него нанести пепел (в пепле Li+ — катализатор).
2) Фермент каталаза. действие каталазы на пероксид водорода.
В пробирки поместить кусочек сырого картофеля и вареного, добавить пероксид водорода. Скорость реакции выделения O2, где сырой картофель, больше, чем с вареным картофелем. Сырой картофель — каталаза — фермент не разрушен.
Можно использовать кусочек мяса — вареное и сырое (для сравнения).
Таким образом, для увеличения скорости химической реакции необходимо учитывать факторы: природу реагирующих веществ, поверхность соприкосновения, концентрацию, температуру, катализаторы.
III. Решение расчетных задач
Задача 1. Написать математические выражения для скоростей реакций, протекающих по уравнениям:
![]()
Задача 2. Как изменится скорость реакции ![]() если концентрацию водорода увеличить в 2 раза?
если концентрацию водорода увеличить в 2 раза?
![]() — до увеличения концентрации водорода.
— до увеличения концентрации водорода.
![]() — с увеличением концентрации водорода.
— с увеличением концентрации водорода.
![]()
Скорость реакции (2) возросла в 4 раза.
Задача 3. Как изменится скорость реакции ![]() если давление уменьшить в 100 раз?
если давление уменьшить в 100 раз?
![]() При уменьшении давления в 100 раз концентрации Н2 и Сl2 уменьшаются в 100 раз ⇒
При уменьшении давления в 100 раз концентрации Н2 и Сl2 уменьшаются в 100 раз ⇒
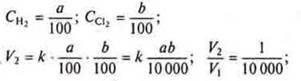
⇒ скорость реакции уменьшится в 10 000 раз.
Задача 4. Во сколько раз увеличится скорость реакции при повышении температуры от 50° до 100°С, если температурный коэффициент скорости равен 2?
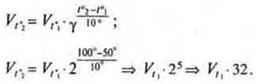
Скорость реакции возрастет в 32 раза.
Задача 5. Определить температурный коэффициент скорости реакции, если при повышении температуры от 10° до 50° скорость реакции увеличилась в 16 раз.
![]()
Ответ: γ = 2.
III. Домашнее задание
§ 13. Задачи № 1—5, устно 6—10.
Подготовиться к самостоятельной работе по всем заданиям.