Поурочные разработки по химии 11 класс
Интегрированный урок по теме «Металлы в природе. Способы получения металлов. Сплавы» - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Тема урока включает материал, который изучается в курсе географии, физики, биологии, экологии и химии; в проведении данного урока принимают участие учителя вышеназванных предметов.
Цели урока: учитель географии объясняет учащимся понятие «руды»; знакомит с коллекцией руд; выясняет, встречаются ли они на территории региона проживания, лабораторным опытом учи определять железняки, работать с картой региона проживания;
учитель химии дает понятие «металлургия»; рассказывает о раз витии металлургической промышленности региона проживания, знакомит с рудами металлов, которые встречаются в природе, разбирает основные способы получения металлов: пирометаллургию гидрометаллургию, электрометаллургию; экспериментально рассматривает пирометаллургию, гидрометаллургию: закрепляет умения составлять ОВР; дает общее представление о сплавах; проводит лабораторный опыт — знакомит со сплавами металлов; дает представление о применении сплавов в различных областях жизни человека;
учитель физики дает представление об электрическом токе в растворах и расплавах электролитов; знакомит учащихся с законами Фарадея, обучает решать расчетные задачи на законы Фарадея, экспериментально проводит электролиз раствора сульфата меди (II);
учитель биологии рассказывает о применении сплавов в медицине;
учитель экологии — об охране окружающей среды, готовит с учащимися рефераты-сообщения.
Основные понятия: руда, металлургия, пирометаллургия, гидрометаллургия, электрометаллургия, электролиз, анод, катод, окисление, восстановление, окислитель, восстановитель, гальваностегия, гальванопластика, сплав.
Оборудование: на столах учащихся для лабораторного опыта руды металлов:
оксиды: Fe3О4, Fe2О3, NH2О, Аl2O3, CuSO4, Fe (скрепка);
сульфиды: Cu2S, PbS, FeS2, KCl, NaCl, (CuOH)2CO3, CuSO4 · H2O, Na3AlF6; слюда, полевой шпат. Карта региона проживания, компас, коллекция «Металлы и сплавы».
На столе учителя CuO, НСl(к), Ag2O(NH3 · Н2O) глюкоза; выпрямитель, CuSO4, прибор для электролиза, металлические штативы, пробирки, держатель для прибора, спиртовка; кодоскоп, кодотранспоранты; тематические газеты и научно-познавательная литература, рефераты.
Ход урока
I. Организационный момент
Постановка целей и задач урока. Организация учащихся на активную работу и течение двух уроков; инструктаж по составлению опорного конспекта.
Рекомендации учителю
1. При проведении интегрированного урока учащиеся составляют конспект урока виде плана (на основе приведенного в книге плана изложения).
Содержание данного урока можно сократить для проведения не интегрированного, а обычного комбинированного урока в течение 45 минут.
План изложения
1. Соединение металлов в природе (учитель химии).
2. Руды металлов. Нахождение руд металлов на территории региона проживания. Металлургия. Развитие металлургии в регионе проживания. Проведение лабораторного опыта № 1. Знакомство с рудами металлов и определение железняков (учителя географии и химии).
3. Способы получения металлов:
а) пирометаллургия (эксперимент), получение меди, серебра:
б) гидрометаллургия (экспериментальное получение Сu. Проведение лабораторного опыта № 2). Получение меди реакцией замещения.
4. Электрометаллургия (учитель химии). Основы теории электролиза. Электрический ток в растворах и расплавах электролитов.
Решение расчетных задач на законы Фарадея и по уравнениям электролиза (эксперимент: электролиз раствора сульфата меди (II)) учитель физики).
5. Получение алюминия электролизом расплава оксида алюминия. Электролиз расплавов солей активных металлов (учитель химии).
6. Применение электролиза растворов и расплавов солей (учитель физики).
7. Охрана окружающей среды: воздуха, почвы, воды (сообщения 1—2 учащихся).
8. Металлы в чистом виде, сплавы металлов и их применение. Проведение лабораторного опыта № 3. Знакомство с металлами и сплавами. Работа с коллекцией (учитель химии).
9. Применение сплавов в медицине (учитель биологии).
10. Обобщение и выводы по узловым вопросам темы.
11. Домашнее задание
§ 18 с. 214-223, № 25, 27.
Задача. Определить объем газа, выделившегося на аноде при электролизе раствора CuSО4 массой 320 г, WCuS04 = 20%.
III. Изучение нового материала
1. Составить электролиз расплава раствора ВаСl2.
2. Решение задачи на электролиз по уравнениям электролиза растворов и расплавов солей.
Задача. При электролизе расплава хлорида натрия массой 7,7 г на аноде выделился газ. Определить объем выделившегося газа.
Урок начинается учителем химии с беседы по вопросам:
Вопрос: Какой следует вывод об активности металлов на основании их химических свойств?
Ответ: По активности металлы можно разделить на а) очень активные, в электрохимическом ряду напряжений условно расположены от Li до Al; б) металлы средней активности от Al— Рb; в) металлы малоактивные от Сu—Au.
Вопрос: В каком виде можно встретить металлы в природе?
Ответ: Можно встретить металлы в виде соединений, а малоактивные в свободном чистом виде.
Вопрос: Как вы считаете, в виде каких соединений можно встретить активные металлы, металлы средней активности, малоактивные металлы?
Ответ: Это могут быть соли, оксиды. Очень активные металлы в природе встречаются в виде солей: хлоридов, нитратов, сульфатов, фосфатов, карбонатов; алюминий — в виде оксида алюминия. Пример на кодотранспоранте:
хлориды: NaCl, KCl;
сульфаты: CaSO4 · 2H2O — гипс, Na2SO4 · 10Н2O — глауберова соль;
нитраты: NaNO3 — чилийская селитра, Ca(NO3)2 — норвежская Памира;
фосфаты: Са3(РO4)2 — фосфориты; карбонаты: СаСO3 — мел, мрамор, известняк;
MgCO3 — магнезит, СаСO3 · MgCO3 — доломит, (СuOН)2СO3 — основная соль, малахит;
силикаты — 2-алюмосиликаты, полевой шпат, слюда, каолинит - они содержат алюминий.
Mеталлы средней активности встречаются в виде оксидов и сульфидов, Оксиды железа: Fe2O3— красный железняк, Fe2O3 · NH2O — бурый железняк, Fe3O4 — магнитный железняк.
Сульфиды: Cu2S — медный блеск, PbS — свинцовый блеск, ZnS — цинковая обманка, FeS2 — пирит, HgS — киноварь.
Металлы малоактивные встречаются:
а) в свободном виде — Au и Pt;
б) в свободном виде и в виде соединений: Ag, Hg, Сu, Sn.
Вопрос: Как же называются все эти соединения? Какое общее название им можно дать?
Ответ: Это руды металлов.
Далее урок ведет учитель географии.
Руды — это минералы и горные породы, содержащие металлы или их соединения, и пригодные для промышленного получения металлов. Если в состав руды входят два или несколько металлов или их соединений — руды называются полиметаллическими (хромистый железняк, свинцово-серебряные руды, медно-молибденовые руды).
Учитель организует учащихся на лабораторную работу № 1:
а) знакомство с рудами металлов: в виде солей — хлорид натрия и калия, сульфидные руды, бокситные руды. Отмечают их внешний вид, возможное сходство:
б) учитель обращает внимание на руды, содержащие железо. Это железняки: красный, бурый, магнитный. Это оксидные руды.
Учащиеся в тетрадях, а учитель на доске составляют таблицу и под руководством учителя описывают свои наблюдения.
|
Руда |
Цвет |
Черта на фарфоре |
Магнитные свойства (компас, магнит) |
|
Fe3O4 — магнитный железняк |
Темно-серый |
Черная |
Обладает магнитными свойствами |
|
Fe3O3 — красный железняк |
Красный |
Красно-бурая |
Слабомагнитные свойства |
|
Fe3O3 · nH2O — бурый железняк |
Бурый |
Бурая |
Не обладает магнитными свойствами |
Эти руды — оксидные — наиболее пригодны для получений металлов.
Далее учитель предлагает учащимся поработать с картой России и картой региона проживания. Отыскать месторождения этих руд и сделать выводы.
Промышленность, которая занимается получением металлов из руд, называется металлургической. Наука о промышленных способах получения металлов из руд называется металлургией. Получение железа и его сплавов считается черной металлургией. Получение остальных металлов относится к цветной металлургии.
Далее объяснение переходит к учителю химии.
А что делать, если руда будет не оксидная, а в виде солей хлоридов, сульфатов, сульфидов? Вот поэтому нам и необходимо знать, как из этих соединений добраться до чистого металла. То есть — способы получения металлов.
Первый способ — пирометаллургия. Это восстановление металлов из руд при очень высоких температурах с помощью углерода, оксид углерода(II), водорода, металлов — алюминия, магния, кальция.
Пример: восстановление меди из куприта, прокаливая его коксом:
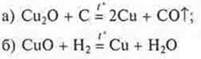 — эксперимент демонстрирует учитель.
— эксперимент демонстрирует учитель.
Эксперимент. Над раскаленным порошком СuО пропускается водород. Яркий блеск меди на стенках пробирки и капельки воды — результат реакции.
Эксперимент. Реакция «серебряного зеркала» в органической химии:
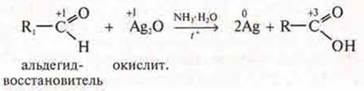
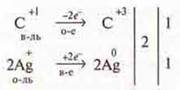 Наблюдается налет серебра на стенках пробирки.
Наблюдается налет серебра на стенках пробирки.
Однако медь, свинец, цинк встречаются в природе в виде сульфидов. Сульфидные руды вначале подвергаются обжигу до оксида металла, а затем полученный оксид восстанавливается углем.
Учитель вызывает ученика к доске, и тот составляет химические реакции, рассматривая их, как ОВР.
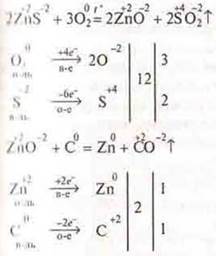
Если руды карбонатные, то их сразу прокаливают углем, т. к. карбонаты разлагаются при высокой температуре до оксидов металла и СО2. В случае с малахитом (СuОН)2СО3.
Эксперимент:
![]()
В промышленности мель из оксида меди(II) восстанавливают углем:
![]()
а также металлы Fe, Cd, Zn, Je, Sn, Pb. Эти металлы не образуют с углем карбиды.
Мы убедились в хороших качествах водорода как восстановителя. В современной металлургии этот восстановитель стал использоваться чаще. Металл получают в виде порошка. Металлургия называется порошковой.
![]() — водородотермия.
— водородотермия.
Активные металлы также применяются для восстановления — это металлотермия:
![]() — алюминотермия;
— алюминотермия;
![]() — магнийтермия.
— магнийтермия.
Вопрос: Какой же процесс происходит во всех разобранных примерах при получении чистого металла? Записать в общем виде:
![]()
Идет процесс восстановления — принятие электронов, катион металла — окислитель, С.О. повышается.
Следующий способ получения металлов — гидрометаллургия. Это восстановление металлов из растворов их солей более активны металлом. Процесс происходит в два этапа:
I этап. Растворение природного соединения в подходящем реагенте для получения раствора соли;
II этап. Из полученного раствора соли металл вытесняют боле активным металлом.
Эксперимент и лабораторный опыт 2.
Учитель растворяет в серной кислоте полученный оксид меди(II) и малахита или готовый химический реактив СuО, или вновь прокаливав вначале малахит и получает СuО.
Эксперимент учитель проводит по I этапу.
![]() — раствор сульфата меди (II).
— раствор сульфата меди (II).
По II этапу учащиеся проводят лабораторный опыт 2.
В раствор CuSO4 (он есть на столах) добавляют железную скрепку:
![]()
и составляют ОВР.
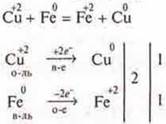
Такой способ несколько дороговат, длителен. Почему? Для этих этапов необходимо получить соль, расходуя готовые реактивы, а для получения металла необходим активный, чистый металл. Он тоже должен быть получен. Для получения очень активных, средней активности и малоактивных металлов применяют — электрометаллургию — это восстановление металлов в процессе электролиза расплавов или растворов солей. Этот вопрос очень тесно соприкасается с физикой. Для объяснения более углубленно теории нам необходим учитель физики.
Учитель физики рассказывает про электрический ток в растворах и расплавах электролитов.
Жидкости, как и твердые вещества, могут быть диэлектриками, полупроводниками и проводниками:
диэлектрики — жидкость, вода;
проводники — растворы и расплавы электролитов (кислоты, щелочи, соли);
полупроводники — расплавы сульфидов, расплавленный селен.
При растворении электролитов в воле происходит электролититическая диссоциаиия. Носителями зарядов в водных растворах или расплавах электролитов являются анионы (-) и катионы (+).
Если сосуд с раствором электролита включить в электрическую цепь, то анионы (-) начнут двигаться к аноду (+), а катионы (+) — к катоду (-). В результате установится электрический ток — направленное движение заряженных частиц. Такую проводимость называем ионной.
При ионной проводимости происхождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролитов. Процесс выделения на электроде вещества, связанный с окислительно-восстановительными реакциями, называют электролизом.
Эксперимент:
Проводится электролиз раствора сульфата меди(II) и учитель химии объясняет ОВР электролиза.
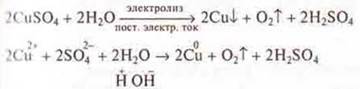
 По ряду напряжений большей окислительной способностью обладает катион меди. На катоде восстанавливается медь!
По ряду напряжений большей окислительной способностью обладает катион меди. На катоде восстанавливается медь!
![]()
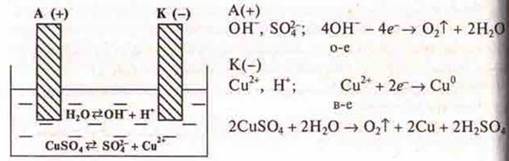
На аноде разрядка воды, но учащимся можно объяснить так:
Вода — слабый электролит, но диссоциация есть и у анода. Будем записывать разрядку аниона, который проще по составу, т. е. ОН-:
![]()
На аноде выделяется кислород.
Таким образом, чтобы выяснить, какой катион разряжается, следует посмотреть его положение в электрохимическом ряду напряжений.
Пример: а) в растворе смесь солей и присутствуют катионы: Cu2+, Ag+, Ni2+ — разрядка идет в последовательности: Ag+, Cu2+, Ni2+;
б) в растворе присутствуют катионы Ni2+, Н+.
Если концентрация Ni2+ очень высокая, то они разряжаются в первую очередь, при снижении концентрации Ni2+ идет разрядка Н+ и Ni2+.
Для выяснения разрядки анионов есть род анионов в порядке убывания их восстановительной способности:
![]()
Убывает способность окисляться (разряжаться на аноде)
Учащимся в ходе эксперимента (в конце) показывают электрод с медью и выделяющиеся пузырьки О2 на аноде. На кодотранспоранте показан рисунок электролиза раствора CuSO4.
Электролиз расплава NaCl:
![]()
Расплав оксида алюминия в криолите:
![]()
Далее учитель физики объясняет законы Фарадея.
Зависимость, называемая законом Фарадея, впервые была установлена экспериментально М. Фарадеем в 30-е гг. XIX в. Этот закон определяет, от чего зависит масса вещества, выделяющегося на электроде за определенное время. Выясним это.
Очевидно, что m = m0 · N, где m0 — масса одного иона; N — количество ионов.
![]()
где М — молярная масса, Na — число Авогадро.
С другой стороны, число ионов, осевших на электроде, можно найти так
![]()
где Q — заряд, прошедший через электролит; q0 — заряд одного иона. Значит, ![]() заряд иона q0 = е- · Z (заряд электрона, умноженный на валентность).
заряд иона q0 = е- · Z (заряд электрона, умноженный на валентность).
Таким образом,
![]()
NA и e- — const. М и Z — постоянны для данного вещества. Значит, можно обозначить ![]()
Тогда закон Фарадея запишется просто: ![]()
где К - электрический эквивалент (кг/кл).
Закон Фарадея: масса вещества, выделившегося на электроде, пропорциональна заряду, прошедшему через раствор.
Масса вещества, выделившегося на электроде, пропорционально силе тока и времени.
Физический смысл К: электрохимический эквивалент равен отношению массы иона к его заряду:
![]()
Исходя из закона Фарадея, в 1784 г. было получено значение элементарного электрического заряда е- = 1,6 · 10-19 Кл.
Учитель химии объясняет далее электролиз расплавов солей, оксидов для получения очень активных металлов.
Пример. Электролиз расплава NaCl:
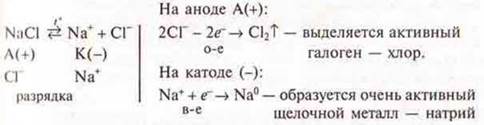
Производство алюминия очень энергоемкий процесс, для получении 1 т алюминия необходимо 19 000 кВт·ч, т. к. t° плавления Аl2O3 свыше 2000°, для снижения этой t° плавления электролиз ведут в криолите Na3AlF6 А(+) — угольные стержни, К(+) — дно ванны.
![]()
Ток очень высок (несколько десятков тыс. ампер), выделяемая током теплота поддерживает Al в расплавленном состоянии.
Составление уравнений электролиза и знание закона Фарадея необходимо и для решения расчетных задач.
Учитель физики дает алгоритм решения расчетных задач по закону Фарадея.
Задача 1
При силе тока 1,6 А на катоде электролитической ванны за 10 мин. отложилась медь массой 0,316 г. Определить электрохимический эквивалент.
![]()
Ответ: К = 0,33 · 10-6 кг/кл.
Задача 2
При никелировании детали в течение 2 ч сила тока, проходящая через ванну, была 0,25 А. К = 3 · 10-7 кг/Кл, с = 8,9 · 103 кг/м3.
Какова толщина никеля, выделившегося на детали 0,2 м2?
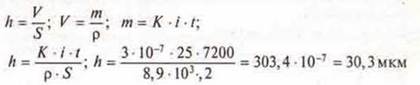
Ответ: 7 = 30,3 мкм.
Учитель химии дает алгоритмы решения расчетных задач и по закону Фарадея и по уравнению электролиза.
Экспериментально установлено, что при пропускании через раствор электролита 96500 кулонов выделяется эквивалент продукта электролиза 96 500 — число Фарадея — F.
![]() Мэ - молекулярная масса элемента, n — С.О. элемента.
Мэ - молекулярная масса элемента, n — С.О. элемента.
![]()
Задача 1
Вычислить массу серебра, выделившегося на катоде при электролизе AgNО3 в течение 10 мин. При силе тока 5 А.
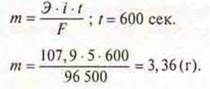
Ответ: mAg = 3,36 г.
Задача 2
Через раствор ![]() пропущено 10 а электричества. На катоде выделилось 11,86 г меди. Определить время электролиза.
пропущено 10 а электричества. На катоде выделилось 11,86 г меди. Определить время электролиза.
![]() или 10 мин.
или 10 мин.
Ответ: t = 10 (мин).
Задача 3
Вычислить массу выделившейся меди при электролизе раствора CuSO4 массой 160 г, WCuSo4 = 20%.
1. Составляем уравнение электролиза:
![]()
2. Далее все решается по алгоритму решения задач, если известно химическое уравнение:
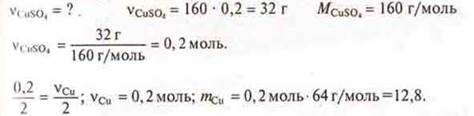
Ответ: mСu = 12,8 г.
IV. Сообщения учащихся
Области применения электролиза:
1. Получение очень активных щелочных и щелочноземельных металлов путем электролиза расплавленных руд.
В настоящее время несколько снижена себестоимость производства алюминия, т. к. его получают из расплава боксита в криолите и наряду с железом он стал самым распространенным в технике и в быту.
2. Гальваностегия — покрытие поверхности металлов тонким слоем трудно окисляемых металлов. Хромирование, омеднение, никелирование, золочение, серебрение. В качестве катода выступает изделие, анод — металл, которым покрывают изделие.
3. Гальванопластика — изготовление рельефных металлических копий предметов. Этот способ изобрел Б. С. Якоби в 40-х гг. XIX в. и применил его для изготовления полых фигур для Исаакиевского собора в С.-Петербурге. Слепок — катод, металл — анод. Изготовление копий в книгопечатании. Так получают стереотипы, только или книг, высококачественной печати.
4. Очистка металлов от примесей. Пример: медь, выплавляемую из руды, помещают в ванну в качестве анода. При электролизе медь анода растворяется, выпадает на дно, а на катоде выделяется чистая медь.
Учитель химии дополняет этот момент и объясняет учащимся понятия «растворимый анод»; «медная болванка», «катод (инертный угольный)»:
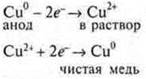
В чистом виде металлы применяются не в большом количестве. Многие их физические свойства для изделий бывают не пригодны. Золото и алюминий — очень пластичные металлы, хром — очень хрупкий и т. п. Поэтому стали получать сплавы металлов.
В природе пример сплавов: полевой шпат, слюда, базальт и даже стекло. Однако металлургические сплавы имеют металлическую химическую связь и обладают соответствующими физическими свойствами, что и металлы в сплаве, но несколько улучшенными. Типы сплавов (кодотранспорант):
а) твердые растворы (атомные решетки металлов одного типа), а в кристалле сплава могут быть разные атомы:
Ag — Сu; Ag — Аu; Сu — Ni;
б) просто сплавы (атомные решетки разного типа, смесь отдельных кристаллов):
Pb — Sn, Bi — Cd, Pb — Ag;
в) интерметаллиды (химические соединения):
Zn и Сu; Са и Sb; Pb и Na.
Опыт 3.
Учащиеся знакомятся с коллекцией «Металлы и сплавы». Состав некоторых сплавов записывают в тетрадь (кодотранспорант).
1) Бронза  Части машин, художественное литье.
Части машин, художественное литье.
2) Латунь ![]() Приборы, детали машин, приборы домашнего обихода.
Приборы, детали машин, приборы домашнего обихода.
3) Дуралюминий ![]() Равен стали по прочности, легче в 3 раза. В самолетостроении.
Равен стали по прочности, легче в 3 раза. В самолетостроении.
4) Легкоплавкий сплав.
Припой, «Третник» 1/3 Рb и 2/3 Sn.
5) Нихром: Ni - 67,5%; Сr - 15%; Fe - 16%; Мn - 1,5%. Жаропрочный. Нагревательные приборы. Нержавеющая сталь, медицинские инструменты, протезы.
6) Победит: С, W, Со — близок к алмазу.
7) Баббит: Sn, Pb, Sb, Сu — заливка подшипников.
8) Sn 50%, In — 50% — для спайки стекла и металла.
Далее выслушивается сообщение учащегося, связанное с требованиями по охране почв, воздуха, воды при производстве металлов, т. к. возможны выбросы в атмосферу газов SО2, СО2, частиц руды, что вызывает «кислотные дожди», гибель растений, животных; болезнь человека.
Учитель биологии рассказывает о применении сплавов в медицине.
Войны в древнем мире приводили к тому, что среди солдат было мною увеченых и калек. И уже тогда встала проблема замены частей тела искусственными. Самыми удачными оказались деревянные ножные протезы (от греч. «протезис» — присоединение), для красоты обернутые тонким бронзовым листом. Протезирование стало возможным из-за того, что в природе можно найти замену костной ткани. Например, зубные протезы начали изготавливаться еще 3000 лет назад этрусками — народом, который жил на территории современной Италии и был уничтожен Римской империей.
В век Просвещения уделяли внимание красоте, белозубой улыбке. Стало популярным протезирование зубов. Использовали для протезирования и воск, и золото, и свинец. Отсутствующие зубы заменяли даже деревянными зубами. Современная стоматология для протезирования использует различные материалы, в том числе и металлы. Только необходимо обязательное знание об их сочетаемости и ротовой полости, где среда щелочная, а разные металлы в среде электролита создают гальванический элемент с определенной силой тока, что для организма не безопасно!
Современные протезы сделаны из легких металлов и сплавов, а также полимеров. Они могут сгибаться в суставах, не разрушаются в электролитной среде организма. Из сплавов металлов изготавливают стержни для укрепления кости при сильнейших переломах.
Потребуется еще много знаний для того, чтобы протезы смогли заменить конечности, чтобы ими человек мог управлять, как своими руками и ногами. Это задачи будущего и решать их вам, нашему подрастающему поколению.
V. Подведение итогов урока
Учитель химии обобщает урок по узловым вопросам, выставляет поурочный балл и задает домашнее задание.