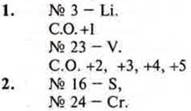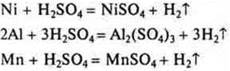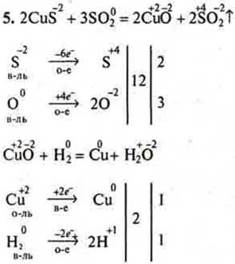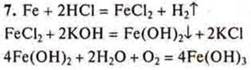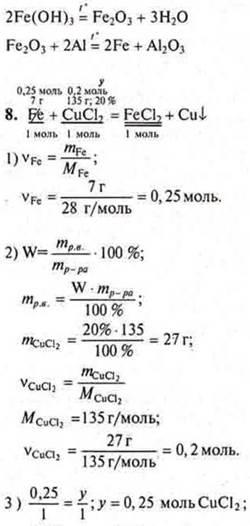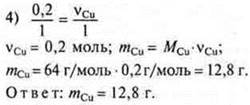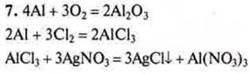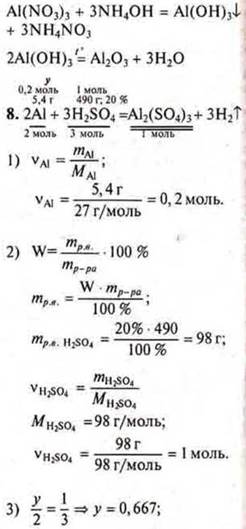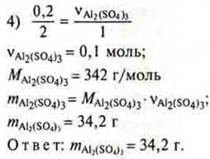Поурочные разработки по химии 11 класс
Урок обобщающего повторения по теме «Металлы» - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: научить применять знания теории в решении упражнений и расчетных задач темы.
Оборудование: карточки-задания на два варианта для парной работы; ответы на карточки-задания, если предусмотрена самопроверка.
Ход урока
I. Организационный момент
Постановка целей и задач урока. Контроль выполнения домашнего задания. Организация учащихся на работу по карточкам-заданий.
Рекомендация учителю
На таких уроках возможна самопроверка выполненных заданий. В таком случае учащимся в конце урока следует предложить ответы на вопросы задания. Это даст учащимся возможность не только совместно выполнять задания, но и сравнивать свои ответы с ответом-эталоном, закрепляя таким образом узловые вопросы темы и работая над допущенными ошибками.
II. Контроль выполнения домашнего задания
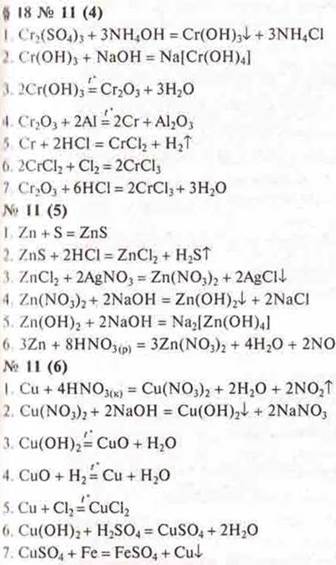
III. Проведение проверочной работы
Содержание карточек-заданий
|
Вариант I |
Вариант II |
|
1. Определить С.О. элементов: |
|
|
№ 3, № 23 |
№ 20, № 43 |
|
2. Почему элементы расположены в одной группе ПСХЭ III Менделеева? |
|
|
№ 16 и № 24 |
№ 17 и № 25 |
|
3. Как изменяется металличность? |
|
|
в периодах |
в главных подгруппах |
|
В чем причина? |
|
|
Расположить элементы в порядке убывания металличности |
|
|
№ 23, 26, 20, 30, 19 |
№ 49, 13, 81, 31 |
|
4. Возможно ли полное растворение сплава в разбавленной серной кислоте? |
|
|
Ni, Si, Al, Mn |
Cu, Fe, Zn, Cr |
|
Дать обоснованный ответ. Составить уравнения химических реакций. |
|
|
5. Составить уравнения реакций получения металлов |
|
|
меди из сульфида меди (II) |
марганца из оксида марганца (IV) |
|
Уравнения разобрать как ОВР. |
|
|
6. Будет ли защищена железная конструкция, если она укреплена болтами из |
|
|
а) свинц. б) марганца |
а) цинка б) никеля |
|
Дать обоснованный ответ. |
|
|
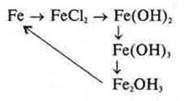
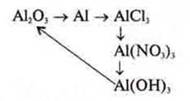
7. Решить схему превращений. Составить уравнения реакций |
|
|
|
|
|
8. Решение расчетных задач. |
|
|
К раствору хлорида меди (II) массой 135,0 г с WCuCl2 = 20 % добавили 7 г железных опилок. Определить массу меди, выделившейся в результате реакции. |
Определите массу образовавшейся соли при взаимодействии 5,4 г алюминия серной кислотой массой 490,0 г, WH2SO4 = 10 % |
Ответы на вопросы карточек-заданий
|
Вариант I |
Вариант II |
|
Они проявляют одинаковую максимальную С.О. +6, оксиды имеют кислотный характер, образуют сильные кислоты: SO3 — H2SO4; СrО3 — Н2СrO4 3. В периодах с возрастанием заряда ядра уменьшается радиус атома — металличность ослабевает: К, Са, V, Fe, Zn. 4. В составе сплава присутствует Si, он не растворяется в серной кислоте. Металлы Ni, Al, Мn в ряду напряжений расположены до водорода. Взаимодействуют с разбавленной H2SO4 и вытесняют водород.
6. Железная конструкция не будет защищена свинцом, т. к. железо активнее свинца и разрушаться будет в первую очередь, в случае с болтами из марганца — разрушаться будет вначале марганец. Однако в любом случае устойчивость конструкции будет нарушена.
у = 0,25 моль CuCl2 требуется, а дано 0,2 моль ⇒ СuСl2 — недостаток. Расчет ведем по недостатку.
|
Они проявляют одинаковую максимальную С.О. +7, оксиды имеют кислотный характер, образуют сильные кислоты: Сl2O7 - НСlO4; Мn2O7 – НMnO4 3. В группах, главных подгруппах с возрастанием заряда ядра увеличивается радиус атома — металличность усиливается: Те, In, Ja, Al. 4. В составе сплава присутствует Сu, она не взаимодействует с разбавленной серной кислотой. В ряду напряжений расположена за водородом. Металлы Fe, Сr, Zn расположены в ряду напряжений до водорода и вытесняют водород из разбавленной H2SO4.
6. Железная конструкция будет защищена цинком, т. к. цинк активнее железа и будет разрушаться в первую очередь, в случае с никелем вначале будет разрушаться железо, т. к. оно активнее никеля. Но устойчивость конструкции будет нарушена в обоих случаях.
у = 0,667 моль Аl требуется, а дано 0,2 моль ⇒ Аl — недостаток. Расчет ведем по недостатку.
|
IV. Домашнее задание
Расчетные задачи § 18 № 28, 29, 30, 31, 32.