Настольная книга учителя по химии 9 класс - поурочные разработки
Предмет органической химии - Органические вещества
Цели урока. Дать понятие о предмете органической химии. Показать особенности органических веществ в сравнении с неорганическими. Сформировать понятие о валентности в сравнении со степенью окисления. Раскрыть основные положения теории строения органических соединений А. М. Бутлерова. Сравнить ее значение для органической химии с теорией периодичности Д. И. Менделеева для неорганической химии.
Оборудование и реактивы. Органические вещества для демонстрации: сахароза, крахмал, уксусная кислота, растительное масло. Шаростержневые модели молекул органических веществ. Оксид меди (II), баритовая (или известковая) вода, прибор для получения газов, парафиновая свеча, прокаленный сульфат меди (II).
I. Введение
Знакомство с новым для школьников разделом — органической химией — учитель начинает с краткого вступления.
С глубокой древности человечество использовало для удовлетворения своих потребностей вещества растительного и животного происхождения. Прежде всего это, конечно, продукты питания, одежда, вещества для выделки кож, растительные и эфирные масла. По мере развития цивилизации люди научились выделять и использовать природные красители, лекарственные и душистые вещества, натуральные волокна и вместе с тем яды, опьяняющие, одурманивающие и взрывчатые средства.
Древние рукописи, летописи и рукописные книги донесли до нас начальные знания наших далеких предков о способах выделения и использования веществ «растительного и животного мира». Алхимики, например, умели получать концентрированную уксусную кислоту и ее соли: ацетат меди (ярь-медянку) и ацетат свинца (свинцовый сахар. Яд. Не любой сахар можно есть!). Первые попытки классификации веществ на органические и неорганические были предприняты еще в IX— X вв. Арабский алхимик Абу Бакр ар-Рази (865—925) впервые разделил вещества на представителей «минерального, растительного и животного царств». Эта классификация просуществовала почти тысячу лет!
На чем основывалось подобное разделение веществ? Давно было замечено, что «растительные и животные» соединения обладают похожими свойствами: легко разрушаются при нагревании, горят, растворяются в спиртах и в маслах. Систематическое изучение этих «нежных» веществ началось с работ выдающихся ученых: шведского химика Карла Вильгельма Шееле и создателя научной химии, француза Антуана Лорана Лавуазье. Они выделили в чистом виде из растительных и животных тел многие органические кислоты (щавелевую, яблочную, лимонную, молочную), глицерин, сложные эфиры уксусной и бензойной кислот. Лавуазье в конце XVIII в. первым высказал причину резкого отличия в свойствах минеральных веществ и продуктов живой природы. При сжигании последних образовывались главным образом углекислый газ и вода. На основании многочисленных опытов он пришел к выводу, что «в состав растительных и животных тел» входит небольшое число элементов: углерод, водород, кислород и также иногда азот и фосфор.
Целесообразно продемонстрировать опыт, подтверждающий наличие углерода и водорода в органическом веществе. В пробирку с газоотводной трубкой, закрепленную в лапке штатива, помещают смесь 1—2 г крахмала с небольшим количеством порошка оксида меди (II), газоотводную трубку опускают в пробирку с баритовой или известковой водой. В верхнюю часть пробирки насыпают немного белого порошка прокаленного (безводного) сульфата меди (II). Пробирку нагревают, наблюдая за обугливанием ее содержимого и помутнением баритовой воды в результате выделения углекислого газа. На холодных стенках пробирки конденсируются капельки воды, которые превращают безводный сульфат меди в кристаллогидрат голубого цвета. Схему реакций можно записать так:
![]()
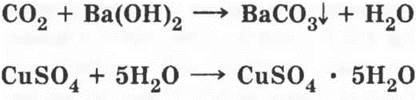
В начале XIX в. назрела необходимость выделить химию веществ растительного и животного происхождения в самостоятельную науку. Возникновение этой науки тесно связано с именем знаменитого шведского химика Йенса Якоба Берцелиуса, давшего ей название «органическая химия». Органическая химия — это химия соединений углерода (кроме простейших: оксидов углерода, угольной кислоты и ее солей).
В заключение этой части урока нужно обратить внимание учащихся на то, что проводить резкую черту между химией органической и неорганической нельзя. Есть много примеров генетической связи между веществами обеих групп. Окончательное крушение витализма (учения о «жизненной силе») связано с именем немецкого химика Альфреда Кольбе, получившего из углерода уксусную кислоту. При нагревании углерода с водородом получается органическое вещество метан, из смеси оксида углерода (II) и водорода в промышленности получают смесь предельных углеводородов (синтетический бензин), а основой жизни на Земле можно по праву считать процесс фотосинтеза, в результате которого в клетках зеленых растений из углекислого газа и воды синтезируется важное органическое вещество — глюкоза:
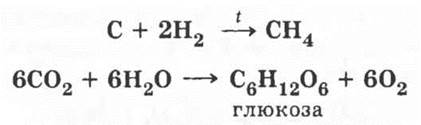
Напротив, органические вещества при горении (как было показано) превращаются в неорганические: оксиды углерода и воду.
II. Электронное строение атома углерода
Поскольку основополагающим элементом органической химии является углерод, учащимся предлагается вспомнить его электронное строение. На помощь приходит Периодическая система Д. И. Менделеева. Порядковый номер углерода — 6, следовательно, его атом содержит 6 электронов. Углерод расположен во втором периоде, значит, электроны располагаются на двух энергетических уровнях. Номер группы, в которой находится углерод (IV), определяет число электронов на внешнем электронном уровне — 4. Учитель акцентирует внимание учащихся, что вследствие этого во всех органических соединениях углерод образует четыре ковалентные связи.
Число химических связей, которые данный атом образует с другими атомами в молекуле, называют валентностью. В органических соединениях углерод всегда четырехвалентен.
Обозначив валентности атомов черточками, можно изобразить полные структурные формулы веществ, например:
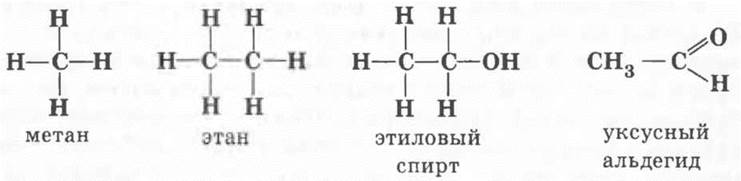
Чаще всего нет необходимости так подробно изображать формулы веществ. Если не показывать связи между атомами углерода и водорода, а «свернуть» их, получается сокращенная структурная формула:
![]()
Еще более «сжатый» вариант обозначения веществ — молекулярные формулы. Они показывают только качественный и количественный состав вещества, но не отражают порядок связи атомов в молекулах:
![]()
Понятие валентности в органической химии более полезно, чем термин «степень окисления», характерный для химии неорганической. Это связано с тем, что большинство органических веществ имеет ковалентный тип связи и молекулярное (а не ионное) строение.
Учащиеся третьего уровня определяют степени окисления каждого атома в приведенных органических веществах, используя определение этого понятия: степенью окисления называется формальный заряд на атоме, вычисленный исходя из предположения, что все ковалентные полярные связи превратились в ионные.
Для закрепления материала учитель предлагает написать структурные формулы, определить валентности и степени окисления атомов нескольких неорганических и органических веществ, формулы которых H2S, HCN, СН3Сl, СН3ОН.
III. Теория строения органических соединений
Вновь подчеркивая единство органической и неорганической химии как двух разделов одной науки, учитель проводит параллель между основным законом неорганики — Периодическим законом Д. И. Менделеева и основополагающей теорией органической химии — теорией химического строения органических соединений А. М. Бутлерова.
А. М. Бутлеров был разносторонне образованным человеком. С детства он увлекался биологией, внес весомый вклад в развитие отечественного пчеловодства, ботаники, сельского хозяйства. Однако делом всей жизни для Бутлерова была химия. Он проводил многочисленные опыты с органическими веществами, синтезировал ряд новых соединений. Анализируя известные к тому времени сведения о составе и свойствах органических соединений, Александр Михайлович формулирует положения теории химического строения. Впервые он изложил их в докладе «О химическом строении тел» на съезде врачей и естествоиспытателей в немецком городе Шпейере 19 сентября 1861 г.
А. М. Бутлеров впервые предложил ввести термин «химическое строение», под которым он понимал порядок связи атомов в молекуле. Основная мысль состоит в том, что атомы связаны между собой в определенной последовательности согласно их валентности, причем неиспользованных валентностей не остается, а углерод в органических соединениях всегда четырехвалентен. Строение каждого вещества может быть изображено только одной структурной формулой. Следствием того, что химические свойства веществ определяются их строением, является вывод о взаимном влиянии атомов в молекулах. «Атомы водорода, соединенные с углеродом, ведут себя иначе, чем соединенные с кислородом», — писал Бутлеров в статье «О различных объяснениях случаев изомерии» в 1863 г.
Нет необходимости давать школьникам все положения теории химического строения, вполне достаточно сформулировать два важнейших, приведенных в учебнике. При этом важно проиллюстрировать их, используя структурные формулы веществ, написанных на доске при объяснении понятия валентность.
В заключение можно предложить учащимся решить простейшую задачу на расчет по химическому уравнению или определению формулы вещества по массовым долям элементов. Алгоритм решения таких задач приведен в уроке 5. При решении задач на расчет объема газов полезно вспомнить и применить закон объемных отношений Гей-Люссака: объемы реагирующих газообразных веществ относятся друг к другу и к объемам газообразных продуктов реакции как целые числа, равные коэффициентам в уравнении реакции.
1-й уровень
1. Какой объем оксида углерода (IV) выделится при сжигании 50 л этана (н. у.)?
2. Углеводород, молярная масса которого 78 г/моль, содержит 92,31% углерода. Определите его молекулярную формулу.
2-й уровень
1. Какой объем воздуха потребуется для сжигания 5 м3 пропана, если объемная доля кислорода в воздухе составляет 21%?
2. Определите молекулярную формулу углеводорода, содержащего 83,72% углерода и имеющего плотность паров по водороду, равную 43.
3-й уровень
1. Какое количество теплоты выделится при сжигании 1,6 м3 метана, объемная доля примеси азота в котором равна 4%, если тепловой эффект реакции составляет 892 кДж/моль CH4?
2. Органическое вещество содержит 38,70% углерода, 45,15% азота и 16,15% водорода. Один литр этого газа при нормальных условиях имеет массу 1,38 г. Определите молекулярную формулу вещества.