Химия - учебно-практический справочник
Кислород и сера - Неметаллические элементы и их соединения. Неметаллы - Неорганическая химия
Кислород
O2 — химическая формула, ![]() ковалентная неполярная связь.
ковалентная неполярная связь.
O2 — газ без цвета, вкуса и запаха, малорастворимый в воде. Жидкий кислород голубого цвета, tкип. = -183 °С. Твердый кислород — синие кристаллы, tпл. = -218,7 °С.
Получение кислорода
1. Разложение бертолетовой соли (хлората калия КСlO3):
![]()
2. Разложение перманганата калия (КМnO4):
![]()
3. Разложение Н2O2 при нагревании при наличии катализатора — оксида марганца(IV) МnO2:
![]()
Химические свойства кислорода
1. Взаимодействует с простыми веществами — как металлами, так и неметаллами.
|
Образуются оксиды |
основные 2Са + O2 = 2СаО |
|
кислотные |
|
|
амфотерные 2Zn + O2 = 2ZnO |
2. Некоторые сложные вещества реагируют с кислородом, образуя оксиды:
![]()
Степени окисления кислорода в соединениях
1. ![]()
2. ![]() — пероксид водорода.
— пероксид водорода.
3. ![]() — фторид кислорода,
— фторид кислорода, ![]() — перфторид кислорода.
— перфторид кислорода.
Применение O2
• в медицине;
• на взрывных работах;
• для сварки;
• для резки металлов;
• в авиации для дыхания;
• в металлургии;
• для интенсификации химических процессов во многих производствах.
Определение кислорода: тлеющую лучину следует внести в пробирку с кислородом — она загорится: кислород поддерживает горение.
Озон — O3
Это бесцветный сильно токсичный газ с резким запахом. Неустойчивый, постепенно превращается в кислород: 2O3 = 3O2.
Озон — аллотропическая модификация кислорода.
O2 и O3 образованы одним и тем же элементом, свойства их различны. 03 разрушает органические вещества, окисляет большинство металлов, в частности Аu и Pt, он более сильныйокислитель, чем кислород. Например, из раствора иодида калия он выделяет иод, тогда как с кислородом эта реакция не происходит.
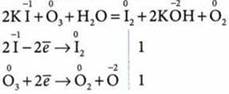
Озон обладает отбеливающим и дезинфицирующим действием.
Сера
В простом веществе атомы серы объединены в цепочки, связь между которыми ковалентная неполярная. Цепочки могут быть закрытыми или открытыми, отсюда — наличие нескольких аллотропных модификаций серы: ромбическая, моноклинная и пластическая сера.
При нормальных условиях сера — ломкое кристаллическое вещество желтого цвета, легкоплавкое, плохо проводит тепло и электричество, не растворяется в воде.
Степени окисления серы в соединениях: -2; +4; +6.
Химические свойства серы
1. Взаимодействует с металлами (кроме Au, Pt, Ir):
![]() — сульфид ртути.
— сульфид ртути.
2. Реагирует с неметаллами:
![]() — сероводород;
— сероводород;
![]() (без доступа воздуха) — сульфид фосфора(III);
(без доступа воздуха) — сульфид фосфора(III);
![]() — фторид серы(VI).
— фторид серы(VI).
3. Реагирует с некоторыми сложными веществами:
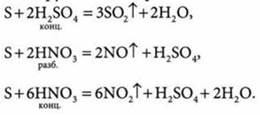
Применение серы
Оксиды серы
SO2 — оксид серы(IV), или сернистый газ, при обычных условиях является бесцветным газом с резким удушливым запахом. При охлаждении до -10 °С сжижается в бесцветную жидкость.
SO2 образуется
1. при сжигании серы: ![]()
2. при нагревании меди с концентрированной серной кислотой: ![]()
Химические свойства SO2
1. При нагревании взаимодействует с O2: ![]()
2. Взаимодействует с Н2O: ![]()
3. Взаимодействует с основными и амфотерными оксидами: ![]()
4. Взаимодействует с основаниями: ![]()
SO3 — оксид серы(VI) — летучая бесцветная жидкость (tкип = 43 °С) с удушливым запахом, кристаллизуется при 16,8 °С.
Химические свойства SO3
1. Взаимодействует с Н2O: SO3 + Н2O = H2SO4 — серная кислота.
2. Взаимодействует с основными и амфотерными оксидами: ![]()
3. Взаимодействует с основаниями: ![]()
Серная кислота
H2SO4 — серная кислота, при обычных условиях бесцветная маслянистая жидкость, без запаха, почти вдвое тяжелее воды, tпл = -10,3 °С, tкип = +280 °С. H2SO4 — сильная двухосновная кислота.
Химические свойства
1. Образует соответствующие соли с металлами, стоящими в ряду активности слева от водорода (кроме Рb):
![]()
2. Взаимодействует с основными и амфотерными оксидами:
![]()
3. Взаимодействует с основаниями:
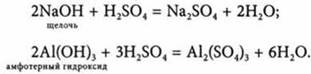
4. Взаимодействует с солями:
![]()
Соли серной кислоты — сульфаты
1. При избытке щелочи образуется средняя соль:
![]()
2. При избытке кислоты образуется кислая соль:
![]()
Большинство сульфатов растворяется в воде.
При выпаривании их растворов часто выделяются кристаллогидраты, например CuSO4 ∙ 5Н2O, FeSO4 ∙ 7Н2O, Al2(SO4)3 ∙ 18Н2O.
Качественная реации на сульфат-ионы
![]()
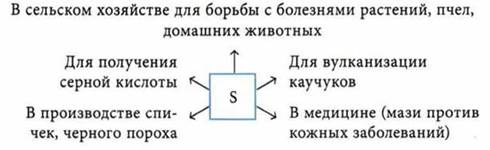
Применение H2SO4 и ее солей
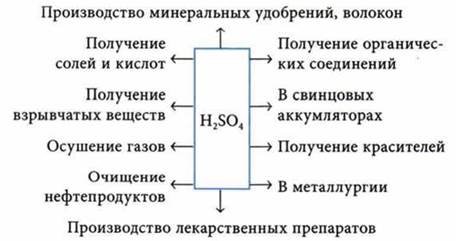
Na2SO4 — в производстве соли и стекла.
K2SO4 — калийное удобрение.
CaSO4 ∙ 2Н2O — гипс в медицине, строительстве, в монументальном искусстве.
CuSO4 ∙ 5Н2O — сульфат меди(II), пентагидрат, или медный купорос, в сельском хозяйстве.
ПРОВЕРЬТЕ СЕБЯ
1. Внешний энергетический уровень атома элемента имеет строение: ns2np4. Кислота, которая соответствует его высшему оксиду, имеет относительную молекулярную массу 98. Назовите элемент.
2. Атом элемента имеет на 6 электронов больше, чем ион магния. Назовите элемент, составьте электронные формулы его атома и иона.
3. Выполните преобразования.
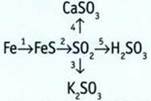
4. Выполните преобразования.
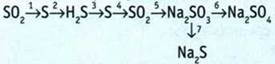
5. Выполните преобразования.
![]()
6. Выполните преобразования.
![]()
7. Как распознать сульфат натрия и хлорид натрия?
8. Укажите степени окисления кислорода в соединениях: CaO; NaOH; OF2; Н2O2; Н3РO4; O2; O2F2.
9. Какой из химических элементов наиболее распространен в земной коре: кислород, сера, железо?
10. Озон — более сильный окислитель, чем кислород. Из раствора иодида калия он выделяет иод, тогда как с кислородом эта реакция не происходит. Запишите уравнение реакции.
11. Какие соли образуются при взаимодействии гидроксида алюминия с серной кислотой? Напишите уравнения химических реакций.
12. При взаимодействии хлорида натрия массой 11,7 г с достаточным количеством концентрированной серной кислоты получен хлороводород массой 6 г. Найдите относительный выход продукта реакции.
13. Как осуществить такие преобразования: ![]()
14. Какое количество теплоты поглощено при получении кислорода объемом 6,72 л (н. у.) в результате реакции 2KNO3 = 2KNO2 + O2, ∆Н0 = 254,8 кДж?
15. Определите массовую долю кристаллизационной воды в медном купоросе.
ТЕСТОВЫЕ ЗАДАНИЯ
1. С какими соединениями взаимодействует серная кислота?
А цинк
Б оксид цинка
B гидроксид меди(II)
Г хлорид натрия
Д хлорид бария
![]()
2. Продуктом взаимодействия оксида серы(VI) с избытком гидроксида натрия является
А сульфат натрия
Б гидросульфат натрия
В сульфит натрия
Г сульфид натрия
3. Укажите количество простых веществ, которые образует элемент кислород.
А 3
Б 4
В 2
Г 5
4. Какое вещество способно образовывать соединения по цепочке: ![]()
А железо
Б натрий
В сера
Г кремний
5. Укажите несолеобразующий оксид.
A SO2
Б SO3
В СO2
Г СО
6. Степени окисления серы в соединениях равны
А +2, +3, +4, +6
Б -2, 0, +4, +6
В -1, 0, +2, +4
Г -2, -1, +4, +6
7. Степени окисления кислорода в соединениях равны
А -2, -1, 0, +2
Б -2, -1, +1, +2
В -2, 0, +1, +2
Г -1, 0, +1, +2
8. Допишите уравнения окислительно-восстановительных реакций, укажите общую сумму коэффициентов: ![]()
А 5
Б б
В 4
Г 7
9. Если в холодную концентрированную серную кислоту погрузить кусочек железа, то мы не заметим взаимодействия веществ. На поверхности металла образуется тонкая пленка оксида, инертная по отошению к кислоте. Какой металл аналогично взаимодействует с этой кислотой?
А натрий
Б алюминий
В магний
Г медь
10. Серная кислота используется в производстве
А соляной кислоты
Б сернистой кислоты
В ортофосфорной кислоты
Г сероводородной кислоты
11. Укажите формулу гипса.
A CuSO4 ∙ 5Н2O
Б CaSO4 ∙ 2Н2O
В K2SO4
Г Na2SO4
12.Образование какого осадка используют как качественную реакцию на сульфат-ионы?
А ортофосфата бария
Б сульфата бария
В карбоната бария
Г сульфида бария
13. Какой реактив используют для проведения качественной реакции на сульфат-ионы?
А хлорид натрия
Б хлорид цинка
В хлорид бария
Г хлорид алюминия
14. Серная кислота относится к
А одноосновным
Б двухосновным
В трехосновным
15. Какой сульфат используется в сельском хозяйстве как средство против болезней и вредителей растений?
A K2SO4
Б CaSO4 ∙ 2Н2O
В CuSO4 ∙ 5Н2O
Г Na2SO4