Химия - учебно-практический справочник
Азот и фосфор - Неметаллические элементы и их соединения. Неметаллы - Неорганическая химия
Азот — N2, ![]()
N2 — газ без цвета, запаха, вкуса, легче воздуха. Низкая растворимость в воде.
Химические свойства
1. С металлами при нагревании образуются нитриды:
![]()
2. Взаимодействует с неметаллами:
а) с кислородом при t > 2000 °С или при t = 400 °С при наличии катализатора:
![]()
б) с водородом:
![]()
Аммиак (NH3)
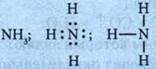
Образование водородных связей:
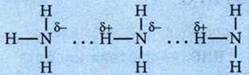
Этим объясняется относительно высокая tкип и высокая теплота испарения аммиака. NH3 — бесцветный газ с резким запахом, почти вдвое легче воздуха. Растворимость в воде чрезвычайно высока. Раствор аммиака в воде (25%) называют нашатырным спиртом.
Получение NH3
1. В лаборатории:
![]()
2. В промышленности:
![]()
Химические свойства
1. Растворение в воде:
![]()
2. Взаимодействие с кислотами:
NH3 + НСl = NH4Cl — хлорид аммония — соль средняя;
![]() — дигидроортофосфат аммония (кислая соль);
— дигидроортофосфат аммония (кислая соль);
2NH3 + Н3РO4 = (NH4)2HPO4 — гидроортофосфат аммония (кислая соль);
![]() — ортофосфат аммония (средняя соль).
— ортофосфат аммония (средняя соль).
Соли аммония
Кристаллические вещества, хорошо растворимые в воде, бесцветные. Их добывают при взаимодействии аммиака или его водного раствора с соответствующими кислотами.
Химические свойства
1. Соли аммония реагируют с другими солями:
![]()
2. Реагируют со щелочами:
![]()
3. При нагревании соли аммония разлагаются:
а) обратимо, если анион соли не является окислителем или обнаруживает слабые окислительные свойства, например:
![]()
б) соли аммония, анионы которых являются окислителями, разлагаются необратимо — происходит окислительно-восстановительная реакция:
![]()
HNO3 — азотная кислота
Чистая кислота, при обычных условиях — бесцветная жидкость с неприятным запахом, тяжелее воды. Летучая. Смешивается с Н2O в любых соотношениях, образуя раствор.
Сильная одноосновная кислота. В разбавленных растворах почти полностью диссоциирует на ионы: ![]()
Химические свойства
1. Взаимодействует с металлами:
а) концентрированная HNO3 с образованием NO2 — оксида азота(IV):
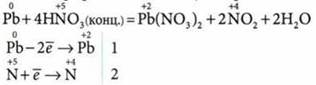
б) разбавленная (20-30%) HNO3 с образованием оксида азота(II) или оксида азота(I):
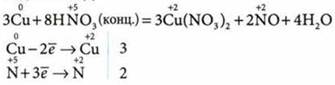
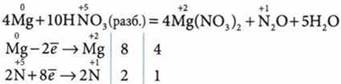
в) при взаимодействии очень разбавленной (менее 10%) HNO3 с металлами образуется нитрат аммония:
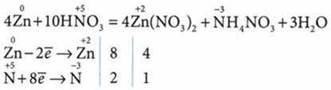
2. Взаимодействует с основными и амфотерными оксидами:
![]()
3. Взаимодействует с основаниями:
![]()
4. Взаимодействует с солями:
![]()
Получение HNO3
В промышленности:
а) синтез аммиака:
![]()
б) каталитическое окисление аммиака кислородом воздуха:
![]()
в) окисление NO до NO2, растворение NO2 в воде:
![]()
В лаборатории: ![]()
Оксиды азотной кислоты
Стенени окисления в N от +1 до +5:
![]()
Оксид азота(II) (NO) — бесцветный газ, плохо растворяется в воде. Непосредственно соединяется с кислородом воздуха, образуя бурый газ — оксид азота(IV): ![]()
NO2 — газ бурого цвета со специфическим запахом, тяжелее воздуха, ядовит. Легко сжижается в жидкость бурого цвета, tкип (NО2) = 21,3 °С. При охлаждении жидкого NО2 образуются бесцветные кристаллы, имеющие tпл (NО2) = -11 °С.
Получение в лаборатории
1) при взаимодействии концентрированной HNO3 с медью:
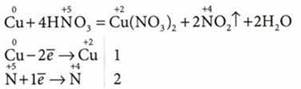
2) при прокаливании кристаллического нитрата свинца:
![]()
Химические свойства NO2
1. Взаимодействует с:
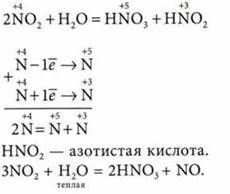
2. Взаимодействует с основаниями (щелочами):
![]()
3. Более характерна окислительная функция. Он легко окисляет H2SO3 до H2SO4, а иодид-ионы до свободного иода:
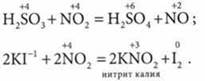
Определение ионов, веществ
|
Определяемый ион или вещество |
Реактив |
Результат реакции |
|
NH4+ |
NaOH |
Запах аммиака
|
|
PO43- |
AgNO3 |
Образуется желтый осадок
|
|
NH3 |
универсальная индикаторная бумага |
цвет бумаги становится синим |
Соли HNO3 — нитраты
Соли HNO3 при нагревании разлагаются, причем продукты разложения зависят от положения металла соли в ряду активности металлов:

Фосфор
В природе фосфор встречается в виде соединений. Важнейшее из них — ортофосфат кальция (минерал апатит). Разновидности апатита составляют осадочные горные породы — фосфориты. Фосфор входит в состав белковых веществ как растительного, так и животного происхождения в виде различных соединений.
Известны три аллотропные модификации фосфора.
|
Белый фосфор |
Красный фосфор |
Черный фосфор |
|
Имеет молекулярную решетку. Легко плавится, летучий. Хорошо растворяется в органических растворителях. Бесцветное кристаллическое вещество, очень ядовитое, огнеопасное, хранят под водой, светится в темноте |
Имеет атомную решетку |
Имеет атомную решетку |
|
Нерастворимые почти во всех растворителях, летучие, неядовитые |
||
![]()
Реакции с белым фосфором происходят легче, чем с красным.
Химические свойства фосфора
Типичные степени окисления фосфора в соединениях: -3; +3; +5.
1. Взаимодействует с металлами, образуются фосфиды:
![]()
2. Взаимодействует с неметаллами:
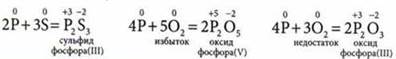
Р2O5 — при нормальных условиях белое, похоже на снег, кристаллическое вещество, очень гигроскопичное. Используют как осушитель газов и жидкостей.
Р2O5 — кислотный оксид.
Химические свойства Р2O5
1. Взаимодействует с основными оксидами:
![]()
2. Взаимодействует со щелочами:
![]()
3. Взаимодействует с водой:
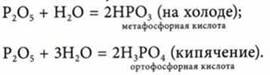
Химические свойства Н3РO4
Н3РO4 — окислительных свойств не проявляет.
1. Реагирует с металлами с образованием трех типов солей.

2. Реагирует с основными оксидами:
![]()
3. Реагирует со щелочами:
![]()
4. Взаимодействует с солями:
![]()
Получение Н3РO4 в лаборатории
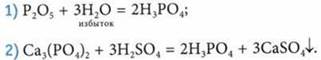
Применение ортофосфатов
Производство минеральных удобрений:
1. Простой суперфосфат
![]()
2. Двойной суперфосфат
![]()
3. Амофос
![]()
Оксиды и все кислородные соединения фосфора намного прочнее аналогичных соединений азота, что объясняется ослаблением неметаллических свойств фосфора по сравнению с азотом.
ПРОВЕРЬТЕ СЕБЯ
1. Высший оксид химического элемента V группы имеет относительную молекулярную массу 142. Назовите химический элемент, составьте формулу оксида и соответствующей кислоты.
2. Высший солеобразующий оксид элемента имеет относительную молекулярную массу 108 и содержит 74,8% кислорода. Назовите этот элемент. К какой группе и подгруппе он относится?
3. Элемент находится в V группе периодической системы химических элементов Д. И. Менделеева. Относительная молекулярная масса высшего оксида вдвое больше относительной молекулярной массы хлора. Назовите элемент, запишите электронную формулу его атома.
4. Запишите уравнения реакций, соответствующие таким преобразованиям:
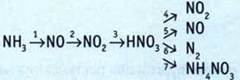
5. В двух пробирках находятся растворы нитрата серебра и ортофосфата натрия. Как распознать вещества, не используя никаких других реактивов?
6. Докажите, что капли дождя во время грозы могут содержать очень небольшое количество азотной кислоты. Напишите уравнения химических реакций.
7. При разложении вещества образуются аммиак и оксид углерода(IV), которые реагируют между собой при наличии воды с образованием карбоната аммония. Запишите уравнение химической реакции.
8. Выполните преобразования.
![]()
9. Выполните преобразования.
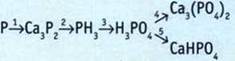
10. Выполните преобразования.
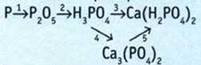
11. При окислении Р разбавленная азотная кислота восстанавливается до NO: ![]() Применив метод электронного баланса, подберите коэффициенты в уравнении этой окислительно-восстановительной реакции. В ответе запишите коэффициент возле окислителя.
Применив метод электронного баланса, подберите коэффициенты в уравнении этой окислительно-восстановительной реакции. В ответе запишите коэффициент возле окислителя.
12. Какой объем оксида азота(II) (н. у.) можно получить нагреванием 20 г медных опилок, содержащих 4% нереагирующих примесей, с достаточным объемом раствора азотной кислоты?
13. Хлороводород, который выделился из 50 г технической поваренной соли при воздействии на нее концентрированной серной кислотой, осаждает полностью серебро из 501,5 мл нитата серебра(I) с массовой долей вещества 15% и плотностью 1,13 г/см3. Определите содержание примесей в этом образце поваренной соли.
ТЕСТОВЫЕ ЗАДАНИЯ
1. При нагревании нитрата калия образуются
А оксид калия + оксид азота(IV) + кислород
Б нитрит калия + кислород
В калий + оксид азота (IV) + кислород
2. Азотной кислоте соответствует оксид
A N2O
Б NO
В N2O3
Г N2O5
3. Азотная кислота образует соли
А нитриты
Б нитриды
В нитраты
Г фосфаты
4. Назовите кислоту, которая используется в металлургии для растворения металлов, очистки их поверхности от оксидов.
А соляная
Б серная
В азотная
Г угольная
5. При термическом разложении нитратов щелочных металлов образуются соединения
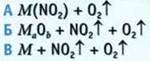
6. Степени окисления азота в соединениях составляют
А -3, 0, +1, +2, +3, +4, +5
Б -3, -1, -2, 0, +1, +4, +5
В -3, -2, 0, +2, +3, +4, +5
Г -3, 0, +1, +2, +4, +5, +б
7. Азотной кислоте соответствует формула
A NH3
Б N2O
В HNO3
Г HNO2
8. При взаимодействии серебра с разбавленной азотной кислотой образуется соединение
А NO
Б NO2
В N2O
Г NH4NO3
9. Укажите сокращенное ионное уравнение реакции обмена между гидроксидом алюминия и азотной кислотой.
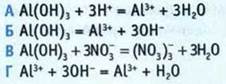
10. Установите соответствие между формулой соли и ее названием.
|
Формула |
Название соли |
|
1 Na3PO4 |
А гидроортофосфат натрия |
|
2 Na2HPO4 |
Б ортофосфат натрия |
|
3 NaH2PO4 |
В нитрат натрия |
|
4 NaNO3 |
Г дигидроортофосфат натрия |
|
|
Д нитрит натрия |
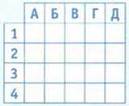
11. Фосфор в соединениях имеет степени окисления
А -3, -2, 0, +5
Б -3, 0, +3, +5
B -3, -2, -1, +5
Г -3, -2, +3, +5
12. Образование какого осадка используют для выявления фосфат-ионов?
А Са3(РO4)2
Б Аg3РO4
В Ва3(РO4)2
Г Рb3(РO4)2
13. Какой реактив используют для проведения качественной реакции на фосфат-ионы?
A NaNO3
Б Ca(NO3)2
В Hg(NO3)2
Г AgNO3
14. Какая кислота содержится в некоторых напитках (кока-кола, концентрированное молоко)?
А серная
Б соляная
В ортофосфорная
Г азотная
15. Какая кислота может образовывать кислые соли?
А азотная
Б хлорная
В ортофосфорная
Г азотистая