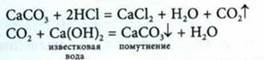Химия - учебно-практический справочник
Углерод и кремний - Неметаллические элементы и их соединения. Неметаллы - Неорганическая химия
Углерод (С)
Аллотропные модификации углерода
|
Алмаз |
Бесцветное кристаллическое вещество с атомной решеткой. Атомы С в кристаллах находятся в состоянии sр3-гибридизации. Они соединены прочными ковалентными неполярными связями. Каждый атом С окружен четырьмя другими, расположенными от него в направлениях от центра тетраэдра к его вершинам (четыре σ-связи). Все это обусловливает твердость, значительную плотность. Алмаз плохо проводит тепло, практически не проводит электрический ток. В чистом виде сильно преломляет свет. |
|
Графит |
Темно-серое кристаллическое вещество со слабым металлическим блеском, жирное на ощупь. Атомы С в кристаллах находятся в состоянии sр2-гибридизации. Они объединены в плоские слои, состоящие из правильных шестиугольников. В них каждый атом С соединен прочными ковалентными связями с тремя соседними атомами (три ст-зсвязи). Связи направлены друг к другу под Z1200. Четвертый валентный электрон каждого атома в слое остается подвижным, как в металле, может перемещаться от одного атома С к другому. Этим объясняется высокая электропроводность, но хуже, чем у металлов, а также его теплопроводность, металлический блеск. Расстояние между слоями в графите достаточно велико (0,335 нм), а силы взаимодействия между ними сравнительно слабые, поэтому он расщепляется на тонкие чешуйки, которые сами по себе очень прочны. Чешуйки легко прилипают к бумаге. |
|
Карбин |
Мелкокристаллический порошок черного цвета. Кристаллы состоят из линейных цепей углеродных атомов, соединенных одинарными и тройными чередующимися связями: (—С≡С—)n. По твердости превосходит графит, но уступает алмазу. Имеет полупроводниковые свойства. При нагревании до 2800 °С без доступа воздуха превращается в графит. |
Аморфный углерод (уголь) образуется в результате нагревания соединений углерода без доступа воздуха и имеет скрытое кристаллическое строение графита. В зависимости от природы исходных веществ бывают такие виды угля: древесный, костный, кокс, сажа.
Уголь (особенно древесный) имеет большую адсорбционную способность.
Адсорбцией называется свойство угля и других твердых или жидких веществ удерживать на своей поверхности пары, газы и растворенные вещества.
Вещества, на поверхности которых происходит адсорбция, называются адсорбентами. Адсорбирующиеся вещества называются адсорбатами.
Адсорбционная способность угля определяется его пористостью. Для усиления адсорбции уголь специально обрабатывают — нагревают в струе водяного пара, чтобы освободить его поры от загрязняющих веществ. Обработанный таким способом уголь называют активированным.
Химические свойства углерода
Степени окисления углерода: -4; +4; +2.
1. Взаимодействует с активными металлами, образуются карбиды:
![]()
2. Взаимодействует с неметаллами:
a) с водородом: ![]()
б) с серой: ![]()
в) с кремнием: ![]()
3. Взаимодействует с оксидами металлических элементов:
![]()
Оксиды углерода
|
Оксид углерода(II) |
Оксид углерода(IV) |
|
СО — бесцветный газ, без запаха, плохо растворяется в воде, очень ядовитый, угарный газ. Несолеобразующий оксид |
СO2 — бесцветный, тяжелый и негорючий газ со слабым кисловатым запахом и вкусом, не поддерживает горение и дыхание |
|
Химические свойства 1. Не взаимодействует с Н2O 2. СО горит в кислороде: 2СО + O2 = 2СО2 3. Взаимодействует с оксидами неметаллических элементов:
В лабораторных условиях получают действием водоотборным средством (H2SO4) на метановую (муравьиную) кислоту: |
СО2 — один из основных компонентов, участвующих в реакции фотосинтеза, осуществляемой в зеленых листьях. В воде растворимость невелика. Твердый СO2 — сухой лед. Химические свойства 1. Взаимодействует с: где Н2СO3 — слабая и неустойчивая двухосновная кислота 2. Взаимодействует с основыми оксидами: 3. Взаимодействует со щелочами, образует два типа солей: а) средние — карбонаты б) кислые — гидрокарбонаты В лабораторных условиях получают действием кислот на карбонаты:
|
Соли угольной кислоты
Угольная кислота как двухосновная образует два ряда солей — карбонаты и гидрокарбонаты, которые известны лишь для активных металлов. Металлы, входящие в состав слабых оснований, образуют только основные карбонаты.
Например, СuСO3 ∙ Сu(ОН)2 — малахит, для висмута известная соль — (ВiO)2СO3 и т. д. Основные карбонаты в воде не растворяются. Значительно выше растворимость у гидрокарбонатов, например, Са(НСO3)2, Ва(НСO3)2. Однако гидрокарбонаты при нагревании переходят в карбонаты: ![]()
Под воздействием СO2 способны растворяться карбонаты кальция, железа(Н), свинца, поскольку при таких условиях образуются гидрокарбонаты, растворимость которых выше, чем карбонатов: ![]()
Карбонаты — термически неустойчивые соединения, при нагревании разлагаются на оксид металла и С02, кроме карбонатов щелочных металлов. Чем сильнее выражены металлические свойства, тем устойчивее карбонат.
Na2CO3 плавится без разложения.
![]()
Применение простых веществ углерода
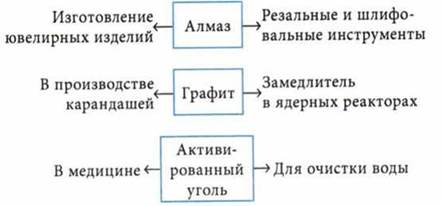
Применение оксидов углерода
СО используют как восстановитель
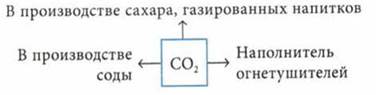
Применение солей угольной кислоты
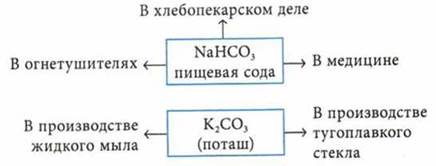
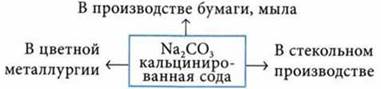
СаСO3 (известняк, мел, мрамор) — в строительстве.
Кремний (Si)
Кремний может как отдавать, так и присоединять электроны, но его способность к присоединению электронов выражена несколько слабее, чем у углерода. Наиболее типичны для Siсоединения, в которых он проявляет степень окисления +4.
Получение кремния
В лаборатории:
![]()
Si бывает аморфный и кристаллический.
Кристаллический Si — твердое вещество с высокой t плавления, металлическим блеском, имеет полупроводниковые свойства и поэтому используется в электронике.
Химические свойства кремния и его соединений
Кремний реагирует при повышенной температуре с кислородом, хлором, серой, щелочами:
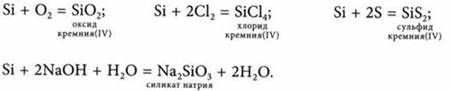
Оксид кремния(IV) — SiO2 — кислотный оксид. Он бывает:
— кристаллический (очень твердый, tпл - 1610 °С, при комнатной температуре в воде не растворяется; не действует ни одна кислота, кроме плавиковой (фтороводородной) HF);
— аморфный (прозрачная стекловидная масса — кварцевое стекло).
SiO2 реагирует
1) с основными оксидами: ![]()
2) с щелочами: ![]()
3) с солями щелочных металлов: ![]()
Кремниевая кислота — H2SiO3 — твердое бесцветное вещество, которое можно добыть из ее соли (силиката) в виде студенистого осадка. H2SiO3 — слабая кислота, она осаждается из раствора под действием СO2 на растворы силикатов. При добавлении кислот к раствору силиката натрия образуется студенистый осадок — гель кремниевой кислоты.
![]()
Из искусственных силикатов очень важно твердое стекло. Состав обычного стекла примерно соответствует формуле Na2O ∙ СаО ∙ 6SiO2. Его добывают сплавлением смеси белого песка с содой и известняком (мелом):
![]()
Применение силикатов
1. Производство прозрачных аморфных сплавов, называемых стеклом:
а) калийное стекло: К2O ∙ СаО ∙ 6SiO2;
б) хрустальное стекло: К2O ∙ РbО ∙ 6SiO2;
в) оконное стекло: Na2O ∙ СаО ∙ 6SiO2.
2. Производство цемента, бетона, железобетона.
3. Производство строительной керамики (кирпич, черепица, трубы, облицовочные плиты), химически стойкой керамики и бытовой керамики.
Определение оксида углерода(IV) и его ионов СО32-, SiO32-
|
Определяемый ион или вещество |
Реактив |
Результат реакции |
|
СО32- |
НСl, Са(ОН)2 |
|
|
SiO32- |
H2SO4 |
|
|
CO2 |
Ва(ОН)2, Са(ОН)2 |
|
Известно много соединений, в которых атомы кремния химически связаны с атомами углерода. Эти соединения называют кремнийорганическими. В 1936 г. советский ученый К. А. Андрианов (1904-1978) разработал метод синтеза высокомолекулярных кремнийорганических соединений, который положен в основу промышленного способа получения ряда продуктов, имеющих ценные свойства. Их используют для придания водоотталкивающей способности стеклу, бумаге, ткани, строительным материалам.
ПРОВЕРЬТЕ СЕБЯ
1. Назовите элемент: находится в IV группе, плотность по водороду высшего оксида равна 22.
2. Элемент находится в IV группе периодической системы химических элементов Д. И. Менделеева. Масса 1 л его высшего оксида при нормальных условиях составляет 1,964 г. Назовите элемент, запишите электронную формулу его атома.
3. Высший оксид элемента имеет общую формулу ЕO2. Элемент образует летучее водородное соединение, плотность которого по воздуху равна 0,552. Назовите элемент.
4. Запишите уравнения реакций, соответствующие таким преобразованиям:
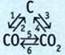
5. Запишите уравнения реакций, соответствующие таким преобразованиям:
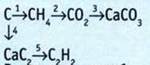
6. Выполните преобразования.
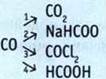
7. Выполните преобразования.
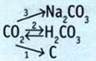
8. Выполните преобразования.
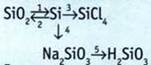
9. Внешний энергетический уровень атома элемента имеет строение: ns2np2. Молекулярная масса летучего водородного соединения одинакова с молекулярной массой кислорода. Назовите элемент.
10. Атом элемента имеет на 4 электрона больше, чем ион магния. Назовите элемент, составьте электронную формулу его атома в возбужденном и невозбужденном состоянии.
11. Выполните преобразования.
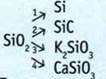
12. При погружении образца технического карбида кальция массой 0,08 кг в воду выделилось 22,4 л ацетилена (н. у.). Определите массовую долю примесей в техническом карбиде кальция этого образца, если массовая доля практического выхода ацетилена равна 100%.
ТЕСТОВЫЕ ЗАДАНИЯ
1. Укажите аллотропные модификации углерода.
А графи.
Б саж.
В алмаз
Г активированный уголь
Д карбин
![]()
2. Массовые доли элементов в соединении магния с кремнием составляют
А 60% Мg и 40% Si
Б 63% Мg и 37% Si
В 57% Мg и 43% Si
Г 67% Мg и 33% Si
3. Укажите качественную реакцию на ионы СО32- и HCO3-.
А взаимодействие с кислотой
Б взаимодействие со щелочью
В взаимодействие с солью
Г взаимодействие с основным оксидом
4. К каким кислотам относится угольная кислота?
А одноосновная
Б двухосновная
В трехосновная
5. Какие соли образуются в случае избытка кислоты при ее взаимодействии с оксидами щелочных и щелочноземельных элементов, щелочами, аммиаком?
А средние
Б кислые
6. Установите сообветствие между формулой соединения и его названием.
|
Формула соединения |
Название |
|
1 Na2CO3 |
А силикатный клей |
|
2 NaHCO3 |
Б кальцинированная сода |
|
3 Na2SiO3 |
В мел |
|
4 СаСO3 |
Г пищевая сода |
|
|
Д доломит |
7. Укажите кислоту, которая является твердым веществом, нерастворимым в воде.
А ортофосфорная
Б кремниевая
В угольная
Г хлорная
8. Укажите кислоту, которая не действует на индикаторы, не реагирует с металлами, многими основными оксидами.
А соляная
Б кремниевая
В серная
Г угольная
9. Силикаты — соли кислоты
А соляной
Б серной
В кремниевой
Г ортофосфорной
10. С каким веществом реагирует силикат калия?
А кислород
Б хлорид натрия
В азотная кислота
Г оксид магния
11. При сгорании 0,24 г простого вещества образовалось 0,448 л газа (н. у.). Определите элемент, если его валентность равна четырем.
А кремний
Б углерод
В сера
Г азот
12. На раствор, содержащий 15 г смеси силиката натрия и сульфата натрия, подействовали избытком соляной кислоты. При этом образовалось 7,8 г нерастворимого вещества. Что это за соединение? Определите массовые доли солей в смеси.
А 80% Na2SiO3, 20% Na2SO4
Б 81,33% Na2SiO3, 18,67% Na2SO4
В 82% Na2SiO3, 18% Na2SO4
Г 85% Na2Si3, 15% Na2SO4
13. Массовая доля воды в кристаллогидрате Na2CO3 ∙ хН2O составляет 62,94%. Определите х.
А 7
Б 8
В 9
Г 10
14. При полном разложении водой карбида кальция массой 2 кг выделился ацетилен объемом 560 л (н. у.). Вычислите массовую долю СаС2 в исходном образце карбида кальция.
А 70%
Б 60%
В 80%
Г 90%
15. Действием избытка соляной кислоты на карбонат кальция массой 25 г получили оксид углерода(IV/) массой 10 г. Определите выход продукта.
А 70%
Б 80,8%
В 90,9%
Г 100%