Химия - учебно-практический справочник
Углерод и кремний - Теоретические основы органической химии - Органическая химия
Органические вещества — это соединения углерода.
В состав молекул органических соединений, кроме атомов углерода, входят атомы водорода, часто еще и кислорода, азота, иногда серы, фосфора. Все эти элементы называют элементами-органогенами.
Особенности состава, строения и свойства неорганических и органических соединений
|
Признаки |
Вещества |
|
|
Неорганические |
Органические |
|
|
Качественный состав |
Наличие углерода не является обязательным в соединениях СO2, КСl, Na2SO4, углерод имеет валентность II и IV |
Обязательно наличие углерода в соединениях С2Н6, НСООН, СН3ОН, углерод всегда имеет валентность IV |
|
Строение |
Молекулярное и немолекулярное |
Преимущественно молекулярное |
|
Химическая связь |
Ковалентная (неполярная и полярная), ионная и металлическая |
Почти всегда ковалентная |
|
Агрегатное состояние |
Газы, жидкости, твердые вещества с низкими или высокими tпл иtкип |
Газы, жидкости, твердые вещества с низкими tпл и tкип |
|
Отношение к нагреванию |
Могут разлагаться при нагревании или плавиться без разложения |
При сильном нагревании без кислорода разлагаются с образованием углерода |
|
Горение |
Горят или не горят. При горении не обязательно образуется СO2:
|
Почти все горят, при этом образуются СО2 и Н2O:
|
Химическая связь в молекулах органических соединений
Энергия связи — энергия, необходимая для разрыва связи (кДж/моль).
Длина связи — расстояние между ядрами атомов после образования между ними химической связи (нм).
Способность атомов участвовать в образовании ограниченного числа ковалентных связей — насыщаемость ковалентной связи.
Ковалентные связи, образованные многовалентными атомами, всегда имеют пространственную направленность. Углы между связями называют валентными.
Ковалентная связь между двумя атомами, которая образована одной парой электронов, называется одинарной (простой), двумя парами электронов — двойной, тремя парами электронов — тройной.
Двойная и тройная химические связи называются кратными. Ковалентные связи различают как о- и л-ковалентные связи, которые отличаются характером перекрытия валентных орбиталей взаимодействующих атомов, а также симметрией распределения электронной плотности связи по отношению к линии, соединяющей центры двух атомов.
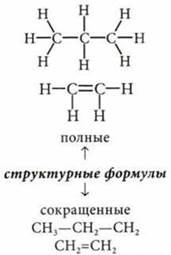
Молекулярное строение углеводородов
|
Углеводороды, общая формула |
Тип гибридизации атомных орбиталей атомов углерода |
Валентный угол |
Химические связи |
Длина связей |
Энергия связей |
|
Насыщенные углеводороды (алканы) СnН2n+2 |
sp3 |
109°28' |
Простые (одинарные) σ-связи |
С-С - 0,154 нм С-Н - 0,198 нм |
С—С-347 кДж/моль С—H-432 кДж/моль |
|
Ненасыщенные углеводороды(алкены) СnН2n |
sp2 |
120° |
Наличие одной двойной связи (σ- и π-) |
С=С - 0,134 нм |
С=С-615 кДж/моль |
|
Ненасыщенные углеводороды(алкины) СnН2n-2 |
sp |
180° |
Наличие одной σ- и двух π-связей |
C≡C - 0,120 нм |
С≡С-812 кДж/моль |
|
Ароматические углеводороды (арены) СnН2n-6 |
sp2 |
120° |
Ароматические — сочетание σ- и π-связей |
С-С - 0,140 нм |
C-С-412 кДж/моль |
Основные положения теории химического строения органических веществ А. М. Бутлерова
|
Основные положения |
Примеры |
|
1. Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности (углерод — IV, водород — I, кислород — II) |
|
|
2. Свойства вещества определяются не только его качественным составом, но и его строением. Это утверждение объясняет явление изомерии |
СН3—СН2—СН2—СН2—ОН - бутанол-I; С2Н5—О—С2Н5 - диэтиловый эфир, этоксиэтан. Молекуле С4Н10О соответствуют два вещества, различные по строению, а следовательно — и по свойствам |
|
Изомеры — соединения, имеющие одинаковый количественный и качественный состав, но разное химическое строение |
|
|
3. Атомы и группы атомов, образовавшие молекулу, взаимно влияют друг на друга, от чего зависит реакционная способность молекулы |
|
Классификация органических соединений
|
Органические вещества |
|||
|
Ациклические (алифатические) |
Циклические |
||
|
Углеводородные СхНу |
Карбоциклические СхНу |
Гетероциклические СхНуEz
|
|
|
Насыщенные (алканы) СН3-СН2-СН3 |
Ненасыщенные Алкены СН2=СН—СН3 Алкадиены СН2=СН-СН=СН2 Алкины СН≡С-СН3 |
Алициклические
Ароматические (арены)
|
|
|
|
|
||
Функциональная группа (ФГ) — группа атомов, которая обусловливает характерные химические свойства веществ данного класса.
|
Функциональная группа |
|||||
|
галогены —F, —Сl, —Br, —I |
гидроксильная —OH |
карбонильная
|
альдегидная
|
карбоксильная
|
аминогруппа —NH2 |
|
Функциональное размещение |
|||||||
|
Галогенпроизводные |
азотсодержащие |
кислородсодержащие |
|||||
|
СН, —Сl CH, —Вr |
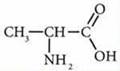
Аминокислоты
|
Амины СН3-СН2-NН2 |
Кетоны
|
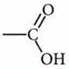
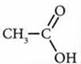
Карбоновые кислоты
|
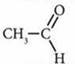
Альдетиды
|
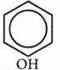
Фенолы
|
Спирты СН3-СН2-ОН |
Гомологический ряд — ряд соединений, которые близки по химическим свойствам, характеризуются закономерной сменой физических свойств, имеют однотипную структуру и отличаются друг от друга на одну или несколько —СН2-групп.
Гомологическая разность — группа атомов — СН2, на которую отличается каждый последующий углеводород в гомологическом ряду от предыдущего.
Гомологи — отдельные члены гомологического ряда.
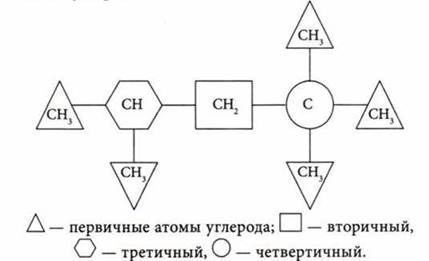
Первичный, вторичный, третичный и четвертичный атом углерода — это атом углерода, соединенный соответственно с одним, двумя, тремя или четырьмя атомами углерода.
Изомерия — явление, при котором могут существовать несколько веществ, имеющих одинаковый состав и одинаковую молекулярную массу, но отличающихся строением молекул.
Различают два основных класса изомеров: пространственные и структурные.
Пространственная изомерия возникает в результате различного расположения отдельных частей молекул в пространстве (геометрические изомеры) или благодаря наличию в молекуле асимметричного центра — атома углерода, связанного с четырьмя различными заместителями (оптические изомеры).
Геометрическая изомерия свойственна молекулам, которые содержат двойную связь или цикл и различные заместители у атомов углерода по разные стороны от плоскости двойной связи или цикла.
Изменение ориентации заместителей требует разрыва связей (при двойной связи должен произойти разрыв π-связи), например:

Оптические изомеры — это молекулы, зеркальные отражения которых несовместимы друг с другом (они отличаются как правая рука от левой).
Структурные изомеры — это изомеры, имеющие различные структурные формулы (порядок сочетания атомов в молекуле).
Структурная изомерия
|
Межклассовая |
СН3—СН2—СН2—СН2—ОН — бутанол-1 С2Н5—О—С2Н5 — диэтиловый эфир, этоксиэтан |
|
Положение функциональной группы |
СН3—СН2—СН2—СН2ОН — бутанол-1
|
|
Разветвления углеродного скелета |
СН3—СН2—СН2—СН3 — бутан
|
|
Положение двойной (тройной) связи |
СН2=СН—СН2—СН3 — бутен-1 СН3—СН=СН—СН3 — бутен-2 |
|
Положение заместителя |
|
Номенклатура органических соединений
Согласно номенклатуре IUPAC, название соединения записывается по следующим правилам:
1. Определяют цепь с наибольшим количеством атомов углерода — главную цепь, вычисляют в ней количество атомов углерода, нумеруют с того конца, к которому ближе радикал или функциональная группа.
2. Основу названия составляет корень слова, обозначающего насыщенный углеводород с таким же количеством атомов углерода, что и в главной цепи.
3. К полученному корню добавляют суффикс, обозначающий степень ненасыщенности главной цепи. Если цепь насыщенная, то суффикс будет -ан, при наличии двойной связи — -ен, тройной — -ин. Если кратных связей несколько, перед суффиксом отмечают их число (например, диен), а после основного названия указывают расположение кратных связей.
4. За суффиксом ненасыщенное™ ставится суффикс, обозначающий функциональную группу, после основы — цифрой обозначают ее расположение.
5. Все остальные заместители обозначают с помощью префиксов. Перед каждым префиксом ставится цифра, которая указывает на положение заместителя. Если есть несколько одинаковых заместителей, то перед соответствующим префиксом указывают их количество и положение.
6. Все цифры в названии отделяют друг от друга запятыми, а от слова — дефисами.
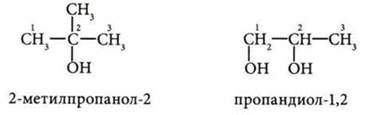
Взаимное влияние атомов или групп атомов в молекулах органических соединений
1. Присоединение галогеноводородов к пропену по правилу Марковникова (реакция соединения).
При взаимодействии веществ типа НХ (где X — галогены, —ОН) у несимметричных алкенов атом водорода присоединяется к наиболее гидрогенизированному (т. е. связанному с большим числом атомов водорода) атому углерода кратной связи, X — к наименее гидрогенизированному.
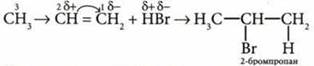
2. Присоединение воды к пропену по правилу Марковникова:
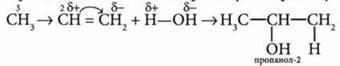
3. Спирты — вещества нейтральные, а реакции со щелочными металлами являются примером проявления спиртами кислотных свойств.
![]()
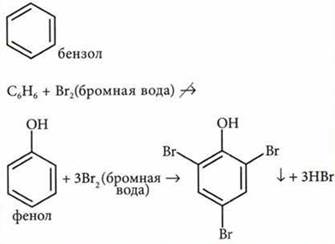
4. Кислотные свойства у фенолов выражены в большей степени, чем у спиртов. Это доказывают реакции фенолов с водными растворами щелочей с образованием солей-фенолятов:
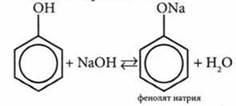 (одноатомные спирты образуют алкоголяты только при взаимодействии со щелочными Фенолят иприя металлами).
(одноатомные спирты образуют алкоголяты только при взаимодействии со щелочными Фенолят иприя металлами).
5. Гидроксильная группа у фенолов сильно активирует бензольное кольцо и способствует реакциям замещения атомов водорода в орто- и пара-положениях.
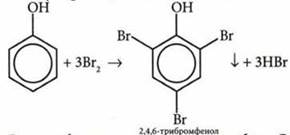
6. Все карбоновые кислоты — слабые. С увеличением молекулярной массы сила кислот уменьшается. Если заменить атомы водорода в углеводородном радикале на атомы более электроотрицательного элемента — галогена, то сила кислоты, т. е. способность ее молекулы к отщеплению ионов Н+, возрастает во много раз. Это результат увеличения полярности связи О—Н вследствие перераспределения электронной плотности в молекуле под влиянием атома галогена.
Перераспределение электронной плотности в молекулах кислот:
а) карбоновой 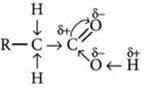
б) дихлоркарбоновой 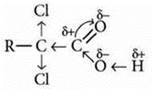
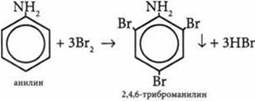
7. Реакция анилина с бромом.
Благодаря неразделенной электронной паре атома азота аминогруппа увеличивает электронную плотность в бензольном кольце и активирует его в орто- и пара-положениях. Анилин легко реагирует с бромной водой:
Классификация химических реакций в органической химии
1. Реакция замещения:
а) замещение водорода галогеном (F, Cl, Br, I) — галогенирование: ![]()
б) замещение водорода нитрогруппой — реакция Коновалова: ![]()
2. Реакция разложения (используют термин «отщепление»): ![]()
Отщепление — каталитическая дегидрогенизация (выделяется водород).
3. Реакция изомеризации (образуется изомер):
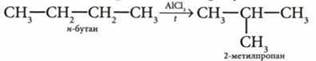
4. Реакция соединения (чаще используют термин «присоединение»):
а) реакция гидрирования (гидрогенизации) — взаимодействие с водородом: ![]()
б) реакция галогенирования — взаимодействие с галогенами:
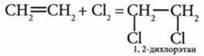
в) реакция с водой — гидратация. Реакция Кучерова:
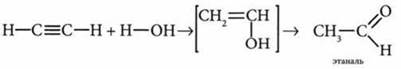
Происходит по правилу Марковникова.
Марковников Владимир Васильевич (1838-1904) — русский химик. Открыл закономерность в порядке присоединения галогеноводородов к ненасыщенным органическим соединениям (правило Марковникова).
ПРОВЕРЬТЕ СЕБЯ
1. Назовите элементы-органогены: Na, С, F, Н, О, Br, N, Р, Са, S, К.
2. Назовите типы гибридизации, характерные для атома углерода. Охарактеризуйте пространственную направленность гибридных орбиталей для каждого типа гибридизации.
3. Укажите, в каких состояниях гибридизации атом углерода может образовывать а) σ-связи; б) π-связи.
4. Найдите вещества с π-связями и определите, сколько σ- и сколько π-связей в молекулах соединений C2H6, C2H4, С2Н2, С3Н8.
5. Какие из приведенных формул соответствуют устойчивым молекулам, а какие — свободным радикалам: C3H8, CH3, C2H5, Н2, ОН?
6. Среди приведенных соединений укажите вещества: а) с ковалентными связями; б) с ионными связями: Н2О, HF, NaF, Н3С—СН2—CH3, KI, СН4.
7. Среди приведенных формул выберите относящиеся к соединениям гомологического ряда метана: C3H6, C3H8,С10Н22, С10Н20, C10H18, С4Н10.
8. Сколько углеводородов с общей формулой С5Н12 содержат в своем составе
А первичные; Б вторичные; В третичные; Г четвертичные атомы углерода?
Запишите структурные формулы этих углеводородов.
9. Напишите структурные формулы всех изомерных углеводородов состава С8Н18, содержащих третичный атом углерода.
10. Какой углеводород, присоединяя бром, образует соединение, формула которого СН3—СНВr—СНВr—СН3? Запишите уравнение реакции, укажите ее тип.
11. Завершите уравнения реакций. Укажите уравнение реакции гидрирования.
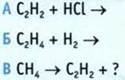
12. Определите формулу алкена, который при взаимодействии с хлороводородом образует 3-хлор,3-метил,4-этилгептан. Назовите этот алкен.
13. Напишите структурные формулы соединений
А 2-хлорбутадиен-1,.
Б 2,5-дибромгексин-3
В 4-хлорпентен-.
Г 1,4-дихлорбутан
14. Какая связь характерна для органических соединений? Как она образуется?
15. Какие характеристики свойственны ковалентной связи?
ТЕСТОВЫЕ ЗАДАНИЯ
1. Многочисленность и разнообразие органических соединений обусловлены способностью атомов углерода
А проявлять валентность II
Б проявлять высокую валентность IV
В сочетаться друг с другом простыми (С—С) или кратными ковалентными связями — двойными (С=С), тройными (С≡С)
Г образовывать неразветвленные, разветвленные и замкнутые цепи
Д наиболее распространенная связь между атомами углерода - ионная
2. Органическая химия изучает соединения
А азота с валентностью V
Б углерода с валентностью IV
В с высокой молекулярной массой
Г углерода с валентностью II и IV
3. Укажите формулы органических веществ.
А СН4
Б С. В Na2CO3 Г NH3 Д С2Н5Сl Е СН3ОН 4. Укажите органические вещества. А жиры Б поваренная соль В глюкоза Г белки Д мрамор 5. Насыщенные углеводороды вступают в реакции А соединения, замещения, взаимодействия со щелочами Б соединения, термического разложения, взаимодействия с кислотами В замещения с галогенами, термического разложения, горения Г полимеризации 6. Для органических соединений характерна связь А ионная Б водородная В ковалентная Г металлическая 7. Соединения, имеющие одинаковый состав, но различное строение молекул, называют А гомологами Б изомерами В углеводородами Г аренами 8. Группа атомов —СН2, на которую отличается каждый последующий углеводород в гомологическом ряду от предыдущего, называется А изомерией Б гомологической разностью В изомерами Г гомологами 9. Веществами-гомологами являются А бутан и бутен Б 2-метилпролан и бутан В бутанол и диэтиловый эфир (этоксиэтан) Г этаналь и пропаналь 10. Веществами-изомерами являются А бутанол и диэтиловый эфир (этоксиэтан) Б бутен и бутин В этаналь и пропаналь Г этан и пропан 11. Установите соответствие между органическим соединением и его связью. Органическое соединение Связь A CH3COONa 1 ионная Б СН3ОН 2 водородная В СН3СООН 3 металлическая Г СН4 12. Какой ученый предложил термин «органическая химия»? А Кекуле Ф. А. Б Бутлеров А. М. В Берцелиус Й. Я. Г Купер А. 13. Явление изомерии открыл А Кекуле Ф. А. Б Либих Ю. В Бутлеров А. М. Г Берцелиус Й. Я. 14. В каком соединении реализуется ионная связь? А этанол Б ацетат натрия В хлорметан Г этановая кислота 15. В каком соединении реализуется водородная связь? А метанол Б бромметан В ацетат калия Г метан![]()
![]()