Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Классификация и номенклатура неорганических соединений - Теоретический материал - НЕОРГАНИЧЕСКАЯ ХИМИЯ
|
№ |
Проверяемые элементы содержания |
|
1 |
Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). |
|
2 |
Характеристика элементов по их положению в Периодической системе |
|
3 |
Характерные химические свойства неорганических веществ: простых веществ-металлов: щелочных, щелочноземельных, алюминия, переходных металлов (меди, цинка, хрома, железа); простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния |
|
4 |
Характерные химические свойства оксидов: основных, амфотерных, кислотных |
|
5 |
Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот |
|
6 |
Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) |
|
7 |
Реакции, подтверждающие взаимосвязь различных классов неорганических веществ |
2.1. Теоретический материал
Классификация и номенклатура неорганических соединений
Все неорганические вещества делятся на простые и сложные. Простыми называют вещества, образованные атомами одного элемента. Например, водород Н2, азот N2, железо Fe и т.д. Понятия “простое вещество” и “химический элемент” различны. Так, химических элементов известно 118, в то время как простых веществ около 450. Это связано с тем, что некоторые химические элементы образуют несколько простых веществ. Данное явление называется аллотропией. Причина аллотропии заключается или в различном составе молекул (например, O2 и O3), или в различном кристаллическом строении аллотропных модификаций (алмаз и графит).
Простые вещества, в свою очередь, делятся на металлы и неметаллы.
Неметаллов известно всего 24. Это водород, инертные газы, углерод, азот, кислород, галогены, кремний, фосфор, сера, германий, мышьяк, селен, сурьма и теллур. Остальным элементам отвечают простые вещества — металлы. Деление на металлы и неметаллы условно. Свойства многих элементов являются промежуточными между свойствами типичных металлов и типичных неметаллов. Есть элементы, у которых одна аллотропная модификация проявляет характерные металлические свойства, а другая — свойства неметалла (например, белое и серое олово).
Сложные вещества состоят из нескольких химических элементов. Например, фосфорная кислота Н3РO4 — из трех (водорода, фосфора и кислорода). Сложные неорганические вещества принято делить на следующие классы.
Схема 1
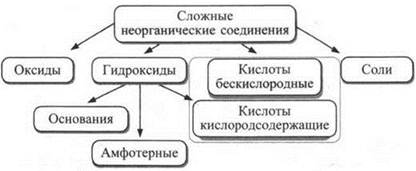
Эта классификация несовершенна и не отражает всего многообразия неорганических веществ. Так, аммиак NH3, не являясь гидроксидом, проявляет тем не менее свойства оснований. Кроме указанных в схеме классов соединений есть и другие (карбиды, нитриды, гидриды и др.), относимые обычно к бинарным соединениям.
Оксиды
Оксидами называются сложные вещества, состоящие из двух элементов, один из которых — кислород в степени окисления -2. Последнее уточнение связано с тем, что существуют и аналогичные по составу пероксиды, содержащие кислород в степени окисления -1. Сравните: Н2O-2 — оксид водорода, Н2O2-1 — пероксид водорода.
Номенклатура оксидов. Названия оксидов составляют из слова “оксид” и названия элемента в родительном падеже (с указанием в скобках степени окисления элемента римскими цифрами):
СuО — оксид меди (II)
Сu2O — оксид меди (I)
NO2 — оксид азота (IV)
N2O5— оксид азота (V)
Иногда используют устаревшие названия без указания степени окисления элемента, указывая, однако, число атомов кислорода, например: СО — монооксид углерода и СO2 — диоксид углерода.
И, наконец, в ряде случаев используют исторически сложившиеся, тривиальные названия, например: Н2O — вода, СO2 — углекислый газ, SO2 — сернистый газ, N2O — закись азота (веселящий газ).
Классификация оксидов. Оксиды делятся на три группы: несолеобразующие, солеобразующие и солеобразные.
Несолеобразующие оксиды (к ним относятся СО, NO, N2O) не взаимодействуют с водными растворами кислот и щелочей с образованием солей. Название “несолеобразующие” условно. Так, оксид углерода(II) не реагирует с водным раствором щелочи при обычных условиях, однако реакция становится возможной с твердой щелочью при сильном нагревании под давлением (при этом образуется соль муравьиной кислоты):
![]()
Несолеобразующие оксиды называют иногда безразличными оксидами.
Солеобразующие оксиды, в свою очередь, делят на кислотные, основные и амфотерные.
Схема 2
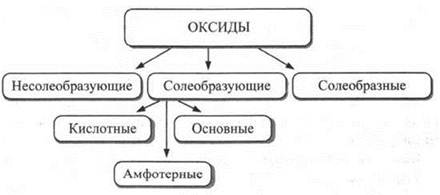
Кислотными называют оксиды, которым соответствуют кислоты. Кислотные оксиды реагируют с основаниями с образованием соли и воды. Это оксиды, образованные неметаллами или переходными металлами в высоких степенях окисления. К ним, например, относятся: СO2, SO2, SO3, Р2O5, SiO2, CrO3, Mn2O7. Кислотные оксиды взаимодействуют с водой (за исключением Si02), образуя соответствующую кислоту:
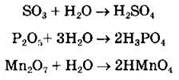
Основными называют оксиды, которым соответствуют основания. Они реагируют с кислотами с образованием соли и воды. В состав основного оксида входят только типичные (активные) металлы. Степень окисления металла в основных оксидах не превышает, как правило, +2. К основным принадлежат оксиды щелочных и щелочноземельных металлов, магния, таллия (I). В школьном курсе химии к основным оксидам относят и такие оксиды, как CuO, MnO, CrO, FeO. Строго говоря, все оксиды переходных элементов проявляют слабоамфотерные свойства, но поскольку основные свойства CuO, MnO, СrО и FeO явно преобладают над КИСЛОТНЫМИ, допустимо считать их оксидами основными.
Амфотерными называют оксиды, проявляющие химическую двойственность. Они сочетают в себе качества как кислотных оксидов (реагируя с основаниями), так и основных оксидов (реагируя с кислотами). Амфотерные свойства проявляют BeO, ZnO, Аl2O3, СR2O3, SnO, SnO2, Sb2O3, Fe2O3и др.
К двойным, или солеобразным, оксидам относят оксиды, содержащие элемент в двух различных степенях окисления, например Fe3O4, Рb3O4 и др. Так, минерал магнетит (железная окалина) Fe3O4содержит катионы железа в двух разных степенях окисления и может рассматриваться, во-первых, как двойной оксид: FeO ∙ Fe2O3или (Fe+2Fe2+3)O4и, во-вторых, как солеобразное соединение Fe+2(Fe+3O2)2.
При взаимодействии с кислотами магнетит образует не одну, а две разные соли:
![]()
Аналогично свинцовый сурик Pb3O4можно рассматривать как двойной оксид (Рb2+2Рb+4)O4 или как соль Рb2+2(Рb+4O4).
Гидроксиды
Гидроксиды можно рассматривать как продукты взаимодействия оксидов с водой. Состав гидроксидов может быть выражен общей формулой ЭОn(ОН)m. Гидроксидами являются гидроксид натрия NaOH, гидроксид магния Mg(OH)2, гидроксид алюминия Аl(ОН)3, гидроксид хрома Сr(ОН)3, гидроксид серы(VI) SO2(OH)2, гидроксид азота(V) NO2(OH).
Классификация гидроксидов. Гидроксиды можно классифицировать следующим образом.
Схема 3
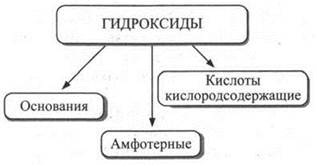
Среди приведенных выше гидроксидов основаниями являются NaOH и Mg(OH)2; амфотерными гидроксидами — Аl(ОН)3 и Сr(ОН)3; кислородсодержащими кислотами — SO2(OH)2и NO2(OH).
Общепринято гидроксиды-основания и амфотерные гидроксиды называть именно гидроксидами, в то время как гидроксиды неметаллов, проявляющих кислотные свойства, относить к кислотам. В этой связи формулы гидроксидов неметаллов записывают так, как это принято для кислот, — на первом месте записывают атом водорода: H2SO4 вместо SO2(OH)2, HNO3 вместо NO2(OH) и т.д.
С точки зрения теории электролитической диссоциации основания — сложные вещества, при диссоциации которых в водных растворах образуются в качестве анионов только гидроксид-ионы ОН-. Металлы, образующие основные оксиды, образуют и гидроксиды-основания. К хорошо растворимым в воде основаниям, проявляющим сильные основные свойства, относятся гидроксиды щелочных и щелочноземельных металлов (Na, К, Sr, Ва и др.). Гидроксиды других металлов практически нерастворимы (например, Сu, Мn и др.). Гидроксиды-основания реагируют с кислотами с образованием соли и воды (реакция нейтрализации).
К амфотерным гидроксидам относятся гидроксиды алюминия, цинка, бериллия, хрома (III), железа (III), сурьмы (III) и (V) и др.
Если элемент-металл проявляет несколько степеней окисления, то основные свойства гидроксидов с ростом степени окисления уменьшаются с одновременным увеличением кислотных свойств. Так, гидроксид хрома (II) Сr(ОН)2 проявляет преимущественно основные свойства, гидроксид хрома (III) Сr(ОН)3 — амфотерные, гидроксид хрома (VI) СrO2(OН)2 — сильные кислотные свойства, т.е. является кислотным гидроксидом.
Примерами кислотных гидроксидов — кислородсодержащих кислот могут быть серная и фосфорная кислоты: H2SO4 (или SO2(OH)2); Н3РO4 (или РО(ОН)3).
Номенклатура гидроксидов. В соответствии с номенклатурными правилами при названии гидроксида после слова “гидроксид” следует указать элемент и его степень окисления (если элемент проявляет постоянную степень окисления, то ее можно не указывать):
NaOH — гидроксид натрия
Mg(OH)2— гидроксид магния
Сr(ОН)2 — гидроксид хрома(II)
Сr(ОН)3 — гидроксид хрома(II)
Н2СrO4 — гидроксид хрома(VI)
Классификация и номенклатура кислот будет дана далее на схеме 4.
Кислоты
Кислотой, в соответствии с теорией Аррениуса, называется вещество, при электролитической диссоциации которого в качестве катионов образуются только ионы водорода Н+. Также существует и иное определение кислот, согласно которому кислота — сложное вещество, состоящее из атомов водорода, способных замещаться на металл, и кислотного остатка.
Главным химическим свойством кислот является взаимодействие с основаниями, которое получило название реакция нейтрализации, приводящее к образованию соли и воды.
Номенклатура кислот. Названия кислот производятся от названия элементов, их образующих. Если элемент образует несколько кислородсодержащих кислот, это отражается в названии кислоты введением суффиксов “-оватая”, “-истая”, “-оватистая” (по мере уменьшения степени окисления элемента). В случае если одной степени окисления отвечает несколько кислот, то в название вводят префикс “ди-” (отражающий наличие двух атомов кислотообразователя) или “мета-”, “орто-” (если кислоты отличаются количеством связанной воды). В таблице 5 приведены формулы, названия кислот (в скобках указаны тривиальные названия) и кислотных остатков некоторых кислот.
Таблица 5
|
Формула кислоты |
Название кислоты |
Название аниона |
|
HF |
фтороводородная (плавиковая) |
фторид |
|
НСl |
хлороводородная (соляная) |
хлорид |
|
HClO |
хлорноватистая |
гипохлорит |
|
НСlO2 |
хлористая |
хлорит |
|
НСlO3 |
хлорноватая |
хлорат |
|
НСlO4 |
хлорная |
перхлорат |
|
НВr |
бромоводородная |
бромид |
|
HI |
иодоводородная |
иодид |
|
НМnO4 |
марганцевая |
перманганат |
|
H2S |
сероводородная |
сульфид |
|
H2SO3 |
сернистая |
сульфит |
|
H2SO4 |
серная |
сульфат |
|
Н2СrO4 |
хромовая |
хромат |
|
Н2Сr2O7 |
дихромовая |
дихромат |
|
HNO2 |
азотистая |
нитрит |
|
HNO3 |
азотная |
нитрат |
|
Н3РО3 |
фосфористая |
фосфит |
|
НРО3 |
метафосфорная |
метафосфат |
|
H3РO4 |
ортофосфорная |
ортофосфат |
|
Н4Р2O7 |
дифосфорная (пирофосфорная) |
дифосфат (пирофосфат) |
|
H2CO3 |
угольная |
карбонат |
|
СН3СООН |
уксусная |
ацетат |
|
H2SiO3 |
метакремниевая |
метасиликат |
|
H4SiO4 |
ортокремниевая |
ортосиликат |
|
Н3ВО3 |
ортоборная |
ортоборат |
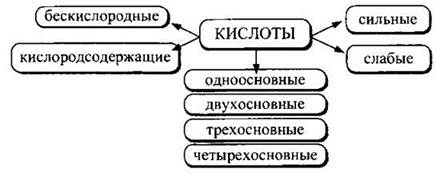
Классификация кислот. По составу кислоты делят на бескислородные и кислородсодержащие (кислородсодержащие кислоты можно рассматривать и как гидроксиды). Примерами бескислородных кислот являются хлороводородная НСl, сероводородная H2S, фтороводородная HF. К кислородсодержащим кислотам (кислотным гидроксидам) относятся серная H2SO4, азотная HNO3, ортофосфорная Н3РO4, хлорная НСlO4.
По числу атомов водорода, способных замещаться на атомы металла, кислоты делят на одноосновные (HF, НСl, НСlO4), двухосновные (H2S, H2SO4), трехосновные (Н3РO4), четырехосновные (H4SiO4).
По силе кислоты делят на сильные, полностью диссоциирующие в разбавленных водных растворах, и слабые, диссоциация которых весьма мала. К сильным кислотам относится не так много кислот, это НСl, НСlO4, H2SO4, HNO3, НМnO4 и некоторые другие. Большинство остальных кислот — слабые.
Кислоты можно классифицировать по растворимости в воде (кремниевые кислоты, в отличие от остальных, в воде не растворяются) и по термической устойчивости (весьма неустойчивы угольная, сернистая, азотистая кислоты, в то время как серная и фосфорная устойчивы к нагреванию).
В общем виде классификацию кислот можно представить в следующем виде
Схема 4
Соли
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков. Роль атомов металлов могут играть и другие катионы, например ионы аммония NH4+. В соответствии с теорией электролитической диссоциации Аррениуса соли — сложные вещества, при диссоциации которых образуются катионы металлов и анионы кислотных остатков.
Номенклатура солей. Названия солей строятся из двух слов — названия аниона в именительном падеже и названия катиона в родительном падеже, например, MgBr2 — бромид магния. Для металлов с переменной степенью окисления ее указывают в скобках после названия, например, Cr(NO3)3— нитрат хрома (III).
Названия кислых солей начинаются с префикса “гидро-” (указание на атомы водорода). Если атомов водорода два, то говорят “дигидро-”. Например, КНСO3 — гидрокарбонат калия, Sr(H2PO4)2— дигидрофосфат стронция. Названия основных солей начинаются с префикса “гидроксо-”, например Сr(ОН)Сl2 — гидроксохлорид хрома (III).
При необходимости назвать кристаллогидрат какой-либо соли к ее названию следует добавить слово “гидрат”, например, CuSO4 ∙ 5Н2O имеет название пентагидрат сульфата меди.
Названия кислотных остатков приведены в таблице 5.
Классификация солей. С точки зрения полноты замещения атомов водорода на металл или гидроксогрупп на кислотные остатки соли можно подразделить на средние, кислые и основные. Выделяют также соли двойные, смешанные и комплексные.
Схема 6
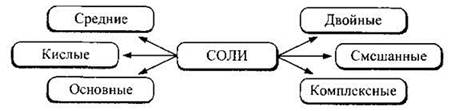
Средние соли можно рассматривать как продукт полного замещения атомов водорода в молекулах кислот на атомы металла. На средние соли приходится подавляющее большинство всех солей. Примеры средних солей: CaF2, Na2SO4, FeS, К3РO4, Са(ОСl)Сl, CaMg(CO3)2.
Кислые соли можно рассматривать как продукт неполного замещения атомов водорода в молекулах кислот на атомы металла. Примеры кислых солей: К2НРO4, КН2РO4, NaHS.
Основные соли можно рассматривать как продукт неполного замещения гидроксогрупп в основаниях на кислотные остатки. К ним принадлежит, например, (СuOН)2СO3 — минерал малахит.
Двойные соли содержат два катиона и один анион. Примером может служить сульфат калия-алюминия KAl(SO4)2.
Смешанные соли содержат один катион и два аниона, например Cu(NO3)Cl. Наиболее известна среди таких солей хлорная (белильная) известь Са(СlO)Сl, являющаяся солью соляной и хлорноватистой кислот.
Комплексные соли содержат в своем составе сложный (комплексный) катион или анион, например [Аl(Н2O)6]Сl3, Na[Al(OH)4], Na3[AlF6] и т.д.