Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Характеристика элементов по положению в Периодической системе - Теоретический материал - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Общая характеристика металлов главных подгрупп I—III групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Все металлы имеют металлическую кристаллическую решетку, в узлах которой расположены положительно заряженные ионы и (значительно меньше) атомы металлов. Валентные электроны, осуществляя химическую связь между ионами, превращают кристалл металла в единое целое. Общность химических свойств металлов обусловлена особенностями строения их атомов: сравнительно большими атомными радиусами, слабым притяжением валентных электронов к ядру, низкими значениями энергий ионизации. Характерное химическое свойство всех металлов — их восстановительная активность. Во всех химических реакциях атомы металлов отдают электроны, проявляя восстановительные свойства. Восстановительные свойства металлов весьма различны и зависят от положения элементов в Периодической системе.
Главную подгруппу I группы (группу IA) образуют щелочные металлы — литий, натрий, калий, рубидий, цезий и франций. На внешнем уровне атомов щелочных металлов содержится по одному валентному электрону ns1. Приведем полные и сокращенные электронные формулы их атомов:
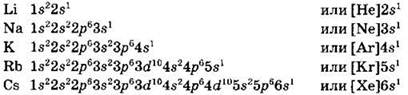
Наличие одного валентного (внешнего) электрона объясняет существование единственной степени окисления щелочных металлов в соединениях, равной +1.
С увеличением радиуса атома от Li к Fr энергия ионизации атомов уменьшается, следовательно, наблюдаемая химическая активность металлов в этом ряду увеличивается. Щелочные металлы среди всех металлов обладают наибольшей химической активностью, являясь очень сильными восстановителями.
Химическая связь в соединениях щелочных металлов — ионная. Ионные кристаллические решетки образуют гидриды щелочных металлов (NaH, КН), галогениды (NaCl, КВr), оксиды (Na2O), соли (NaNO3, K2SO4), гидроксиды (NaOH) и т.д. Оксиды и гидроксиды элементов IA группы проявляют сильноосновный характер, гидроксиды МОН относятся к щелочам. Сила оснований возрастает в ряду от LiOH к CsOH. Соли щелочных металлов не подвергаются гидролизу по катиону.
Главную подгруппу II группы (IIА группу) образуют элементы бериллий, магний и щелочноземельные металлы кальций, стронций, барий и радий. На внешнем уровне атомы этих элементов имеют по два электрона (общая электронная конфигурация ns2), обуславливая степень окисления +2:
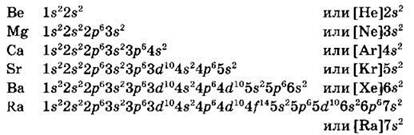
Простые вещества в свободном виде менее реакционноспособны по сравнению с щелочными металлами. Химическая активность возрастает при переходе от бериллия к радию. Оксид и гидроксид бериллия обладают амфотерными свойствами, оксиды и гидроксиды остальных элементов IIА группы проявляют свойства оснований. Сила оснований по ряду Ве(ОН)2 — Rа(ОН)2возрастает. Если соли бериллия существенно гидролизованы в растворе, то соли магния — лишь в малой степени, а соли остальных металлов IIА группы не подвергаются гидролизу.
Типичным представителем элементов IIIA группы является алюминий. Электронная конфигурация внешнего уровня атома алюминия 3s23p1. Три валентных электрона обуславливают характерную степень окисления алюминия +3. По значению стандартного электродного потенциала алюминий должен относиться к химически активным металлам, однако прочная оксидная пленка уменьшает наблюдаемую химическую активность. Алюминий легко взаимодействует как с простыми, так и со сложными веществами (кислотами, солями). Возможна также реакция с водой и щелочами. Оксид и гидроксид алюминия относятся к амфотерным соединениям, легко взаимодействуя как с кислотами, так и с щелочами. Соли алюминия в водном растворе подвергаются гидролизу.
Характеристика переходных элементов — меди, цинка, хрома, железа по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
Особенностью атомов переходных элементов является заполнение электронами внутренних d- или f-подуровней. Элементы, в атомах которых достраивается (n-1)d-подуровень, называют d-элементами. Элементы, в атомах которых достраивается (n-2)f-подуровень, называют f-элементами. Переходные элементы образуют побочные подгруппы (В группы) Периодической системы Д. И. Менделеева. Все переходные элементы образуют простые вещества-металлы.
Валентными в атомах переходных элементов являются внешние s- и пред внешние d-электроны, что предполагает наличие нескольких степеней окисления и разнообразие в химических свойствах d-элементов.
Типичными переходными элементами являются медь, цинк, хром, железо. Электронные конфигурации атомов этих элементов, а также проявляемые ими степени окисления приведены в таблице 6.
Таблица 6
|
Элемент |
Группа |
Электронная конфигурация |
Степени окисления |
|
Сr |
VIB |
[Ar]3d54s1 |
+2, +3, +6 |
|
Fe |
VIIIB |
[Ar]3d64s2 |
+2, +3, +6 |
|
Сu |
IB |
[Аr]3d104s1 |
+1, +2 |
|
Zn |
IIB |
[Ar]3d104s2 |
+2 |
Обращает на себя внимание “проскок” электрона в атомах хрома и меди с внешнего на предвнешний уровень.
Анализ изменения кислотно-основных свойств соединений переходных элементов показывает, что с повышением степени окисления элемента основные свойства его оксидов и гидроксидов уменьшаются, а кислотные свойства возрастают. Так, в ряду соединений хрома производные в степени окисления +2 проявляют отчетливые основные свойства, в то время как в степени окисления +6 — кислотные свойства. Производные в степени окисления +3 — типичные амфотерные соединения:
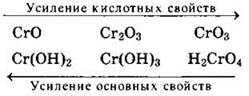
Анализ изменения окислительно-восстановительных свойств показывает, что производные в низких степенях окисления могут проявлять заметные восстановительные свойства, в то время как в высших степенях окисления — сильные окислительные свойства. Так, в ряду соединений железа производные в степени окисления +2 являются хорошими восстановителями, а в степени окисления +6 — сильными окислителями:
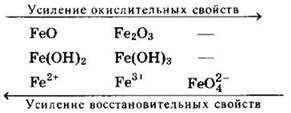
В то же время соединения железа (III) могут проявлять и восстановительные, и окислительные свойства.
Общая характеристика неметаллов главных подгрупп IV—VII групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Элементы-неметаллы располагаются в правом верхнем углу Периодической системы элементов Д.И. Менделеева. К неметаллам относятся:
|
Период |
Группа |
|||||
|
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
|
1 |
H |
He |
||||
|
2 |
В |
С |
N |
O |
F |
Ne |
|
3 |
Si |
Р |
S |
Cl |
Ar |
|
|
4 |
Ge |
As |
Se |
Br |
Kr |
|
|
5 |
Sb |
Те |
I |
Xe |
||
|
6 |
At |
Rn |
||||
Общая электронная конфигурация валентных электронов атомов неметаллов ns2np1-6 объясняет многообразие степеней окисления неметаллов в их соединениях.
По сравнению с металлами атомы неметаллов имеют большее число электронов на внешнем энергетическом уровне, а следовательно, имеют большую тенденцию к присоединению электронов до скорейшего завершения внешнего энергетического уровня. Отсюда — ярко выраженная окислительная способность неметаллов и высокие значения электроотрицательностей их атомов.
Водород — первый элемент в Периодической системе Д.И. Менделеева, помещаемый обычно и в IA группу (вместе с щелочными металлами), и в VIIA, группу (вместе с галогенами). Это объясняется особенностями его электронного строения. Атом водорода имеет электронную конфигурацию 1s1, сходную с электронной конфигурацией атомов щелочных металлов (ns1). В то же время атому водорода, как и атомам галогенов, не хватает до завершения внешнего уровня одного электрона. Поэтому водород может проявлять две степени окисления: +1 (как щелочные металлы) и -1 (как галогены). Примерами таких соединений являются:
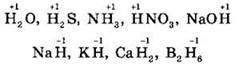
Галогены — элементы VIIA группы. К галогенам относятся фтор, хлор, бром, иод и астат. Астат — радиоактивный элемент, полученный искусственно, в природе практически не содержится. Многие свойства астата изучены недостаточно.
Атомы галогенов характеризуются аналогией в строении внешней электронной оболочки. Все галогены имеют внешнюю электронную конфигурацию ns2np5:
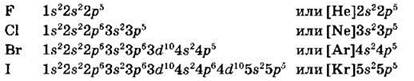
Сходство в строении внешней электронной оболочки объясняет и сходство в свойствах самих галогенов.
Так, все галогены — окислители. Атомы галогенов стремятся присоединить электрон до завершения внешнего энергетического уровня, поэтому все галогены образуют устойчивые производные в степени окисления -1. Поскольку фтор является самым электроотрицательным элементом, он проявляет единственную степень окисления -1. Остальные галогены образуют производные и в положительных степенях окисления: +1, +3, +5 и +7.
Молекулы галогенов двухатомны. В ряду простых веществ: фтор — хлор — бром — иод температуры кипения и плавления возрастают.
Элементы кислород, сера, селен, теллур и полоний образуют VIA группу. Первые 4 из них имеют неметаллический характер, полоний относится к металлам. Элементы VIA группы имеют одинаковую электронную конфигурацию валентных электронов ns2np4. До завершения внешнего уровня не хватает двух электронов, поэтому низшая степень окисления кислорода, серы, селена и теллура равна -2. Высшая степень окисления равна номеру группы, а именно +6. Для кислорода не существует производных в высшей степени окисления. Для кислорода возможны степени окисления -1 (в пероксидах Н2O2, Na2O2, ВаO2), +1 и +2 (во фторидах кислорода O2F2 И OF2). В ряду кислород, сера, селен, теллур, полоний увеличивается радиус атома, уменьшается энергия ионизации, уменьшается электроотрицательность. По химическим свойствам кислород и его аналоги — типичные неметаллы, хотя и менее активные, чем галогены.
Элементы азот, фосфор, мышьяк, сурьма и висмут образуют VA группу. С увеличением атомного радиуса по подгруппе увеличивается атомный радиус, уменьшается энергия ионизации, уменьшается электроотрицательность. Это приводит к ослаблению неметаллических и к возрастанию металлических свойств — так, висмут относится к металлам. Электронная конфигурация внешнего энергетического уровня ns2np3 объясняет существование низшей степени окисления -3 и высшей, равной +5. Степень окисления -3 проявляется в водородных соединениях состава Н3Э, положительные степени окисления характерны для оксидов, гидроксидов (кислот) и солей, например Э2O3, Э2O5, Э(ОН)3, НЭO2.
Элементы углерод, кремний, германий, олово и свинец образуют IVА группу. Радиусы атомов увеличиваются от углерода к свинцу, энергия ионизации и электроотрицательность уменьшаются. Это приводит к ослаблению неметаллических свойств и к усилению металлических. Так, углерод и кремний относятся к типичным неметаллам, у германия появляются признаки металлических свойств, а олово и свинец являются металлами. Степени окисления неметаллов IVA группы могут быть от низшей, равной -4, до максимально возможной +4. Наряду с этими степенями окисления существуют устойчивые производные и в степени окисления +2. Оксиды углерода и кремния(IV) проявляют кислотные свойства, оксиды остальных элементов этой группы амфотерны.