Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Химические свойства простых неорганических веществ - Теоретический материал - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Химические свойства простых веществ
Характерные химические свойства простых веществ-металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
Химические свойства щелочных металлов. Щелочные металлы обладают наибольшей среди всех металлов химической активностью, являясь очень сильными восстановителями. Так, они вытесняют водород не только из кислот, но и из воды и даже из спиртов:
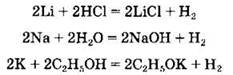
Литий взаимодействует с водой относительно спокойно, натрий — бурно, калий воспламеняется в контакте с водой, рубидий и цезий реагируют взрывообразно.
Все щелочные металлы довольно легко окисляются кислородом воздуха (поэтому хранят их или в керосине, или под слоем минерального масла, или в вакуумированных ампулах).
Продукты взаимодействия щелочных металлов с кислородом различны. Если литий окисляется до оксида, то натрий образует в основном пероксид, а калий — надпероксид:
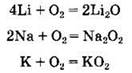
Пероксиды и надпероксиды щелочных металлов являются сильнейшими окислителями, бурно разлагающимися водой, например:
![]()
Щелочные металлы реагируют практически со всеми неметаллами (исключая инертные газы).
Несмотря на высокую активность, щелочные металлы не используют для выделения других металлов из водных растворов их солей, поскольку щелочные металлы в первую очередь взаимодействуют с водой.
В то же время щелочные металлы можно использовать как восстановители при взаимодействии с расплавленными солями. В частности, взаимодействием калия и хлорида алюминия был получен первый образец металлического алюминия:
![]()
Все соли щелочных металлов хорошо растворимы в воде.
Качественной реакцией на ионы щелочных металлов является окрашивание пламени: ионы лития окрашивают пламя в карминово-красный цвет, ионы натрия — в желтый, ионы калия — в фиолетовый.
Получают щелочные металлы электролизом расплавов хлоридов или гидроксидов, а также вытеснением другими активными металлами:
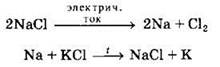
Протекание последней реакции возможно из-за большей летучести калия по сравнению с натрием.
Химические свойства металлов IIА группы. Химическая активность металлов IIА группы ниже, чем у щелочных металлов. По ряду Be—Ra атомный радиус увеличивается, энергия ионизации атомов уменьшается, следовательно, химическая активность металлов по подгруппе увеличивается. Наименее активен бериллий. Свойства бериллия сильно отличаются от свойств остальных элементов IIА группы, приближаясь к свойствам алюминия. Так, оксид и гидроксид бериллия проявляют амфотерные свойства в отличие от оксидов и гидроксидов щелочноземельных металлов.
На воздухе бериллий и магний вполне устойчивы, т.к. покрыты прочной оксидной пленкой. При высокой температуре эти металлы взаимодействуют с кислородом, окисляясь до оксидов. Кальций и другие щелочноземельные металлы, будучи более активными, окисляются кислородом уже на холоду:
![]()
При нагревании все металлы IIА группы взаимодействуют с галогенами, серой, азотом, фосфором.
С водой бериллий не реагирует даже при высокой температуре, в то время как магний взаимодействует с горячей водой, а кальций и его аналоги — даже с холодной:
Все металлы IIА группы легко растворяются в кислотах, образуя соли:
![]()
Бериллий в силу амфотерности его оксида и гидроксида может взаимодействовать и с растворами щелочей с образованием гидроксобериллатов:
![]()
В ряду оксидов ВеО—MgO—СаО—SrO—ВаО—RaO основность возрастает, такая же тенденция прослеживается и в ряду гидроксидов. Если ВеО и Ве(ОН)2 проявляют амфотерные свойства, то остальные оксиды и гидроксиды — исключительно основные. Гидроксиды кальция, стронция, бария и радия являются сильными основаниями и относятся к щелочам.
Химические свойства алюминия. Химическая активность алюминия довольно высока, в ряду активности металлов он расположен непосредственно за щелочноземельными металлами и магнием.
Проявляя сильные восстановительные свойства, алюминий реагирует с неметаллами, кислотами, солями, оксидами, а также растворами щелочей.
Кислородом алюминий окисляется с образованием оксида:
![]()
Металлический алюминий с поверхности всегда покрыт тонкой пленкой оксида, образование которой объясняет пониженную химическую активность металла по сравнению с той, которой он должен обладать по положению в ряду активности.
Из-за высокой теплоты образования Аl2O3 (1676 кДж/моль) металлический алюминий способен восстанавливать многие оксиды до свободных металлов:
![]()
Эта реакция (реакция алюминотермии) используется в промышленности при получении бария, стронция, ванадия, хрома, вольфрама и др. Так, алюминий при нагревании способен выделить даже щелочноземельный металл барий из его оксида:
![]()
Галогены взаимодействуют с алюминием с образованием галогенидов, например:
![]() (бромид алюминия)
(бромид алюминия)
Алюминий взаимодействует также с серой, фосфором, азотом, углеродом. Алюминий легко взаимодействует с кислотами с образованием солей:
![]()
В то же время концентрированные серная и азотная кислоты без нагревания на алюминий не действуют (пассивация металла).
Алюминий может вытеснять менее активные металлы из растворов их солей, например:
![]()
АЛЮМИНИЙ может взаимодействовать как с твердыми щелочами (при сплавлении с ними), так и с водными растворами щелочей. При нагревании с твердыми щелочами алюминий образует оксоалюминаты:
![]()
Гидроксоалюминаты образуются при растворении алюминия в растворах щелочей:
![]()
![]() (при избытке щелочи).
(при избытке щелочи).
При удалении с алюминия прочной оксидной пленки (например, при амальгамировании или действии щелочей) активность алюминия повышается настолько, что возможно его взаимодействие с водой:
![]()
Наиболее важное соединение алюминия — его оксид. И оксид, и гидроксид алюминия, проявляя амфотерные свойства, взаимодействуют как с кислотами, так и с щелочами (или другими реагентами кислотной или основной природы), например:
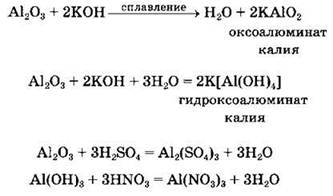
Химические свойства переходных металлов. Медь, цинк, хром и железо — типичные представители переходных металлов. Химическая активность переходных металлов, как правило, несколько ниже, чем непереходных металлов. Только цинк и марганец проявляют химическую активность, приближающуюся к алюминию и магнию.
Все переходные металлы окисляются кислородом при нагревании с образованием характерных оксидов:
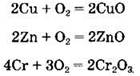
Железо окисляется, в зависимости от температуры, с образованием оксидов FeO, Fe3O4и Fe2O3:
![]()
Оксид состава Fe3O4называется железной окалиной. Его можно рассматривать как двойной оксид, содержащий железо в двух степенях окисления: FeO∙Fe2O3, или как Fe+2(Fe+3O2)2. В природе Fe3O4встречается в виде минерала магнетита (магнитного железняка).
При нагревании металлы реагируют с такими неметаллами, как сера, углерод, азот, фосфор, галогены, например:
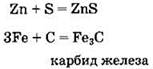
Фтор, хлор и бром окисляют железо до степени окисления +3, в то время как иод (слабый окислитель) — до степени окисления +2:
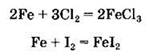
Аналогично медь по-разному взаимодействует с галогенами:
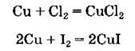
С водой цинк и железо реагируют при высоких температурах, образуя оксиды и водород:
![]()
В присутствии кислорода железо медленно взаимодействует с водой, окисляясь до гидроксида железа (III):
![]()
Эта реакции лежит в основе процесса ржавления железа. Медь с водой не взаимодействует.
Железо, цинк и хром, находясь в электрохимическом ряду металлов до водорода, взаимодействуют с кислотами, выделяя водород, например:
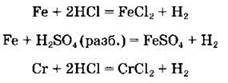
Концентрированными азотной и серной кислотами железо и хром на холоду пассивируются, однако при нагревании возможны и эти реакции, например:
![]()
Медь в ряду активности металлов располагается после водорода, поэтому, как правило, не выделяет водород из кислот. Порошок меди медленно при нагревании взаимодействует с концентрированной соляной кислотой с выделением водорода и с образованием комплексного соединения меди(I):
![]()
В присутствии окислителей медь легко растворяется не только в соляной кислоте, но и в растворе аммиака:
![]()
Лучшим растворителем для меди является азотная кислота или концентрированная серная:
![]()
С водными растворами щелочей переходные металлы практически не реагируют.
Переходные металлы могут взаимодействовать и с солями, вытесняя из них менее активные металлы, например:
![]()
Характерные химические свойства простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
Химические свойства водорода. Рассмотрим свойства водорода как простого вещества. При обычных условиях водород довольно мало активен, что объясняется высокой прочностью его молекулы Н2: энергия связи Н—Н равна 430 кДж/моль. Однако при нагревании или в присутствии катализатора, ослабляющего связь в молекуле, химическая активность водорода усиливается.
Так, для водорода возможны реакции с простыми веществами:
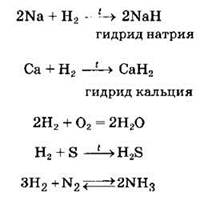
Последняя реакция протекает при нагревании, под давлением в присутствии катализатора.
Взаимодействует водород и с галогенами с образованием галогеноводородов, например:
![]()
Реакция водорода со фтором протекает в любых условиях (даже в темноте при охлаждении до температуры -196 °С) и сопровождается взрывом. Взаимодействие водорода и хлора требует яркого освещения, необходимого для инициализации процесса (появления активных радикалов). Взаимодействие водорода с бромом протекает только при нагревании, а с иодом — при нагревании в присутствии катализатора.
С такими неметаллами, как бор, кремний, фосфор, мышьяк, селен, теллур и инертные газы, водород не взаимодействует.
Реагирует водород и со сложными веществами, например:
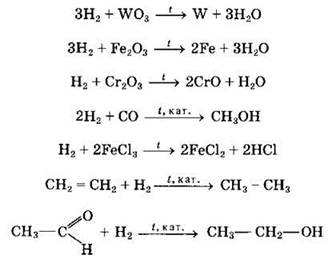
В органической химии реакции присоединения водорода называются реакциями гидрирования. Среди рассмотренных примеров только при взаимодействии с металлами водород проявляет окислительные свойства, во всех других реакциях водород действует как восстановитель.
Химические свойства галогенов. Фтор — самый реакционноспособный неметалл, соединяется со всеми другими металлами и неметаллами, исключая гелий, неон и аргон. Неметаллы фтором окисляются, как правило, до высших степеней окисления.
Фтор настолько сильный окислитель, что способен окислять даже инертные (благородные) газы:
![]()
Фтор вытесняет другие галогены из галогенидов, а также кислород из воды:
![]()
Химическая активность других галогенов ниже по сравнению с фтором, причем окислительная способность в ряду убывает:
![]()
Так, хлор реагирует с железом с образованием трихлорида, а иод — с образованием дииодида железа:
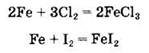
Сравните следующие уравнения реакций:
![]()
Непосредственно с галогенами не реагируют только кислород, азот, гелий, неон и аргон.
Отдельно рассмотрим взаимодействие галогенов с водородом. Фтор, как самый сильный окислитель, реагирует с водородом со взрывом при любых условиях, даже при низких температурах и в темноте:
![]()
Взаимодействие хлора с водородом требует сильного освещения для своего начала:
![]()
Эта реакция протекает по цепному радикальному механизму, который включает в себя три стадии:
— инициализация цепи под действием кванта световой энергии с образованием радикалов:
![]()
— развитие цепи за счет последовательно протекающих реакций:
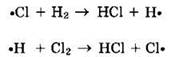
— обрыв цепи за счет взаимодействия двух радикалов:
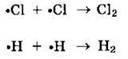
Взаимодействие брома с водородом происходит только при нагревании:
![]()
Взаимодействие иода с водородом относится к эндотермическим реакциям и, кроме нагревания, требует присутствия платины как катализатора:
![]()
Эти факты также свидетельствуют о снижении химической активности и окислительной способности в ряду галогенов.
Кроме простых веществ, галогены активно взаимодействуют со сложными веществами.
Если взаимодействие фтора с водой сопровождается окислением ее до свободного кислорода:
![]()
то взаимодействие с водой других галогенов протекает иначе. Так, при растворении хлора в воде (“хлорная вода”) происходит диспропорционирование хлора с понижением и повышением степени окисления:
![]()
При этом в растворе наряду с растворенными молекулами хлора образуются две кислоты — хлороводородная и хлорноватистая.
В щелочной среде равновесие смещается вправо, поэтому взаимодействие галогенов с щелочами носит практически необратимый характер:
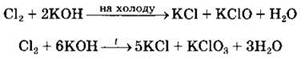
На холоду хлор окисляется до степени окисления +1 с образованием гипохлорита калия, а при нагревании — до степени окисления +5 с образованием хлората калия.
Галогены могут взаимодействовать не только с неорганическими, но и с органическими веществами, вступая с ними в реакции присоединения или замещения, например:
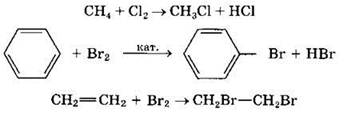
обесцвечивание бромной воды является качественной реакцией на непредельные соединения.
Химические свойства кислорода. Элемент кислород образует два простых вещества — кислород O2 и озон O3. Рассмотрим вначале химические свойства кислорода.
Благодаря высокой электроотрицательности кислород — довольно сильный окислитель — реагирует с большинством простых и сложных веществ.
Из простых веществ не окисляются кислородом только благородные металлы, галогены и инертные газы, в остальных случаях образуются оксиды или пероксиды, например:
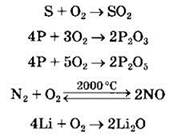
Кислород взаимодействует также со сложными веществами, как неорганическими, так и органическими, например:
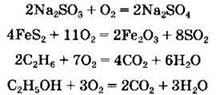
Во всех приведенных примерах кислород выступает как окислитель.
Озон — другая аллотропная модификация кислорода. Он более сильный окислитель, чем кислород. Это связано с легкостью разрыва одной из связей в молекуле O3 с образованием атомарного кислорода:
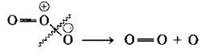
Озон реагирует с аммиаком, окисляя его до нитрата:
![]()
Озон реагирует с сульфидами, окисляя их до сульфатов:
![]()
Если с кислородом серебро не взаимодействует даже при нагревании, то озон, в отличие от кислорода, окисляет металлическое серебро до оксида (наряду с Ag2O образуется AgO):
![]()
Качественной реакцией на озон является выделение иода при пропускании газа через раствор иодида калия:
![]()
Химические свойства серы. Существует несколько аллотропных модификаций серы, среди которых при обычных условиях наиболее устойчива сера ромбическая. Молекулы ромбической серы состоят из восьми атомов: S8. При обычных условиях сера химически малоактивна, но при нагревании ее активность возрастает. Сера взаимодействует с неметаллами, металлами, сложными веществами, проявляя свойства и восстановителя (с более электроотрицательными элементами), и окислителя (с менее электроотрицательными элементами).
Например, сера как восстановитель вступает в реакции с более сильными окислителями:
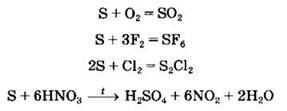
Сера как окислитель:
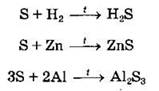
Для серы возможны также реакции диспропорционирования (одновременного окисления-восстановления). Так, при нагревании с щелочами протекает реакция диспропорционирования серы до степеней окисления -2 и +4:
![]()
Так как для химии серы характерно образование цепочек ...—S—S—S—..., то элементарная сера может реагировать с некоторыми серосодержащими веществами с образованием соединений, содержащих несколько атомов S. Так, при кипячении раствора сульфита натрия сера легко присоединяется к сульфит-иону с образованием тиосульфат-иона (S2O32-):
![]()
Сульфиды щелочных металлов легко присоединяют избыток серы с образованием полисульфидов:
![]()
Химические свойства азота. Как простое вещество азот состоит из двухатомных молекул N2. При обычных условиях он обладает весьма низкой реакционной способностью. Это связано с высокой прочностью тройной связи в молекуле азота: для разрыва тройной связи необходима энергия 945 кДж/моль. И даже при нагревании активность азота возрастает незначительно. Так, при нагревании азот взаимодействует с водородом, кислородом, активными металлами:
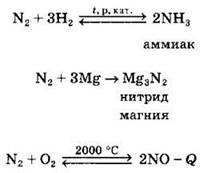
Если в первых двух реакциях азот — окислитель и восстанавливается до степени окисления 3, то в последней реакции азот проявляет восстановительные свойства.
Важнейшие соединения азота — аммиак NH3, азотистая кислота HNO2, азотная кислота HNO3 и их соли.
Химические свойства фосфора. Элемент фосфор образует несколько простых веществ: белый фосфор, красный фосфор, черный фосфор. Известны и другие аллотропные модификации фосфора. Белый фосфор имеет молекулярное строение, его молекула состоит из четырех атомов Р4. Остальные модификации имеют атомные (координационные) решетки.
Наибольшей химической активностью обладает белый фосфор, он самовоспламеняется уже при 40 °С, поэтому хранят его под водой. Химическая активность красного фосфора намного ниже.
Фосфор в химических реакциях может быть как восстановителем:
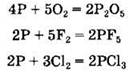
так и окислителем:
![]()
Когда необходимо показать, что в реакцию вступает именно белый фосфор, то уравнение реакции записывают с участием молекул Р4. Так, при взаимодействии белого фосфора с горячим раствором щелочи выделяется газ фосфин:
![]()
Наряду с фосфином в этой реакции образуется соль фосфорноватистой кислоты Н3Р02. Другим способом получения фосфина является гидролиз фосфидов в воде или в растворе кислоты:
![]()
Напрямую фосфор с водородом практически не взаимодействует. Следует отметить, что в отличие от аммиака фосфин обладает лишь весьма малыми основными свойствами.
Фосфор легко окисляется сильными неорганическими окислителями, такими как HNO3 или КМnO4:
![]()
При сильном нагревании фосфор взаимодействует с водой с образованием ортофосфорной кислоты:
![]()
Эта реакция лежит в основе одного из промышленных способов получения ортофосфорной кислоты.
Химические свойства углерода и кремния. Углерод и кремний — элементы IVA группы. В своих соединениях углерод и кремний могут проявлять степени окисления от минимальной -4 до максимальной, равной номеру группы, +4. Вот примеры соединений углерода в различных степенях окисления:
-4 метан СН4, карбид алюминия Аl4С3
-2 хлорметан СН3Сl
-1 карбид кальция СаС2
0 дихлорметан СН2Сl2, формальдегид HСНО
+2 угарный газ СО, муравьиная кислота НСООН
+3 щавелевая кислота Н2С2O4
+4 углекислый газ СO2, карбонат кальция СаСO3.
Углерод и кремний относятся к типичным неметаллам. Для углерода характерна аллотропия. Существуют следующие аллотропные модификации углерода: алмаз, графит, карбин и фуллерен.
В противоположность атомам других элементов атомы углерода могут соединяться в цепи и замкнутые циклы:
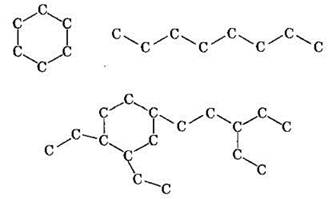
что объясняет существование огромного числа органических соединений.
При обычных условиях и углерод, и кремний обладают малой реакционной способностью. Однако нагревание резко усиливает их химическую активность, углерод и кремний при нагревании реагируют со многими простыми и сложными веществами.
При нагревании с кислородом оба неметалла образуют оксиды, проявляя восстановительные свойства:
![]()
При нагревании возможны реакции с галогенами, серой, другими неметаллами:
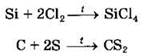
Окислительные свойства для углерода и кремния проявляются только в реакциях с металлами:
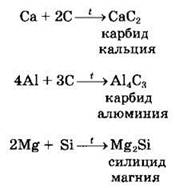
Восстановительные свойства углерода и кремния при высокой температуре настолько велики, что как тот, так и другой используют в промышленных методах получения металлов:
![]()
Кремний может взаимодействовать с щелочами при нагревании, образуя силикаты:
![]()
Углерод и кремний могут взаимодействовать друг с другом, образуя карбид кремния:
![]()
Карбид кремния под названием карборунд используется как эффективный абразивный материал.