Химия - Единый государственный экзамен - Комплекс материалов для подготовки учащихся - 2018 год
Нахождение молекулярной формулы вещества - МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ - ЗАДАНИЯ ДЛЯ ТЕМАТИЧЕСКОГО КОНТРОЛЯ
Задания с комментариями и решениями
Пример 23. При сгорании 0,31 г газообразного органического вещества выделилось 0,224 л углекислого газа, 0,45 г воды и 0,112 л азота. Плотность вещества 1,384 г/мл. Установите молекулярную формулу этого соединения и назовите его.
Начать решение задачи следует с составления уравнения реакции сгорания органического азотсодержащего вещества
![]()
Из уравнения реакции видно, что число моль атомов, входящих в состав исходного вещества, соответствует числу моль образовавшихся продуктов реакции.
Рассчитав число моль продуктов по формуле ![]() можно определить массы атомов элементов С; Н; N и установить, содержится ли в сгоревшем веществе атомы кислорода.
можно определить массы атомов элементов С; Н; N и установить, содержится ли в сгоревшем веществе атомы кислорода.

2) Сумма масс элементов (0,12 + 0,05 + 0,14) равна массе навески вещества (0,31 г), значит, кислород в веществе отсутствует.
3) Исходя из полученных количеств веществ можно составить простейшую формулу
К : L : N = 0,01 : 0,05 : 0,01 = 1 : 5 : 1.
Следовательно, простейшая формула CH5N (М= 31 г/моль).
Это же и истинная молекулярная формула (т.к. из условия М= 1,384 ∙ 22,4 = 31 г/моль).
Этим соединением является метиламин CH3NH2.
Пример 24. При сгорании 0,62 г газообразного органического вещества выделилось 0,448 л углекислого газа, 0,9 г воды и 0,224 л азота (объемы газов измерены при н.у.). Плотность вещества по водороду 15,50. Установите молекулярную формулу сгоревшего соединения.
Прежде всего, необходимо рассчитать количества веществ, образовавшихся при горении. Это нужно для того, чтобы найти количества веществ атомарных углерода, водорода и азота:
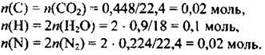
Далее проверяем, содержится ли в веществе кислород. Для этого находим сумму масс элементов углерода, водорода и азота и сравним ее с массой сгоревшего вещества:
![]()
Сумма масс элементов равна массе навески вещества, значит, кислород в веществе отсутствует. Устанавливаем простейшую формулу вещества. Очевидно, что соотношение числа моль атомов таково
С : Н : N = 0,02 : 0,1 : 0,02 = 1 : 5 : 1.
Простейшая формула CH5N. Из условия задачи найдем молярную массу соединения. Она равна М= 15,5 ∙ 2 = 31 г/моль. Действительно, молярная масса CH5N равна 31 г/моль. Следовательно, простейшая формула и будет истинной молекулярной формулой.
Пример 25. При сжигании газообразного углеводорода с плотностью по кислороду 1,312 получено 16,8 л углекислого газа и 13,5 г воды. Определите молекулярную формулу углеводорода.
Находим количества веществ углекислого газа и воды:
![]()
Находим количества вещества атомов углерода и водорода и устанавливаем простейшую формулу углеводорода:
![]()
Соотношение n(С): n(Н) = 0,75 : 1,5 = 1 : 2.
Простейшая формула СН2.
Рассчитываем молекулярную массу углеводорода (исходя из его плотности) и устанавливаем истинную молекулярную формулу его.
Молярная масса углеводорода, исходя из его плотности по кислороду, равна
![]()
Молярная масса простейшей формулы равна
М(СН2) = 14 г/моль.
Эта втрое больше молярной массы простейшей формулы, следовательно, простейшую формулу следует утроить. Окончательно установленная молекулярная формула сгоревшего углеводорода: С3Н6.
Пример 26. При сгорании 3,2 г органического соединения образовалось 2,24 л углекислого газа и 3,6 г воды. Плотность паров этого соединения по гелию равна 8. Установите его молекулярную формулу.
Находим количества веществ углекислого газа и воды:
![]()
Находим количества веществ атомов углерода и водорода и проверяем, содержится ли в соединении кислород:
![]()
следовательно, ![]()
![]()
следовательно, m(Н) = 0,4 г.
Так как масса углерода и водорода (1,6 г) не совпадает с массой сгоревшего вещества (3,2 г), то разница должна приходиться на массу кислорода:
![]()
Находим соотношение числа атомов элементов и установим простейшую формулу сгоревшего соединения. Соотношение числа атомов составит
![]()
Простейшая формула СН4O.
Очевидно, это и настоящая молекулярная формула, т.к. ее молярная масса совпадает с молярной массой, найденной по плотности по гелию: М = 4 ∙ 8 = 32 г/моль. Эта молекулярная формула отвечает метанолу СН3ОН. Называть соединение в ответе необязательно, так как в условии задания это не требуется.
Пример 27. При сгорании газообразного органического вещества, не содержащего кислород, выделилось 2,24 л (н.у.) углекислого газа, 1,8 г воды и 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
Как и в предыдущих задачах, сначала рассчитываем количества веществ, образовавшихся при горении:
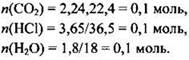
Зная количества веществ, образовавшихся при сгорании, можно рассчитать количества веществ атомов углерода, хлора и водорода в исходном соединении:
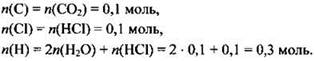
Обращаем внимание на последнее равенство. Необходимо учесть, что атомы водорода входят в состав не только воды, но и хлороводорода.
![]()
Таким образом, простейшая формула сгоревшего соединения может быть записана как СН3Сl. Эта простейшая формула является и истинной молекулярной формулой. Действительно, если попытаться удвоить или утроить ее, то получатся химически ошибочные формулы, не отвечающие реальным соединениям. Например С2Н6Сl2 не может существовать, так как число атомов водорода и хлора превышает число свободных валентностей углерода.
Итак, правильный ответ СН3Сl (хлорметан).
Пример 28. При сжигании образца некоторого органического соединения массой 14,8 г получено 35,2 г углекислого газа и 18,0 г воды.
Известно, что относительная плотность паров этого вещества по водороду равна 37. В ходе исследования химических свойств этого вещества установлено, что при взаимодействии этого вещества с оксидом меди(II) образуется кетон.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с оксидом меди(II).
Судя по продуктам сгорания, органическое вещество может содержать углерод, водород и кислород. Запишем общую формулу вещества - CxHyOz
Найдём количество вещества продуктов сгорания:
![]()
Найдём соотношение элементов:
х : у : z = 0,8 : 2 : 0,2 = 4 : 10 : 1
вычисленная формула С4Н10О
Вычислим молярную массу: MBЫЧ(CxHyOz) = 74 г/моль;
Используя относительную плотность по водороду определим истинную молярную массу:
![]()
Молекулярная формула исходного вещества С4Н10О
Такую формулу может иметь простой эфир и предельный одноатомный спирт. Учитывая то, что при взаимодействии этого вещества с оксидом меди(II) образуется кетон, определяем, что это - спирт. Причем, гидроксогруппа находится у второго атома углерода. Составим структурную формула вещества:
![]()
Запишем уравнение реакции вещества с оксидом меди(II):
![]()
Пример 29. В результате сплавления органического вещества с гидроксидом натрия был получен алкан, 0,9 г которого занимают объем 672 мл (н.у.).
Известно, что исходное вещество относится к классу солей. В этом соединении количество атомов кислорода равно количеству атомов углерода.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции сплавления исходного органического вещества с гидроксидом натрия.
Рассчитаем молярную массу алкана:
![]()
Найдем количество атомов углерода и определим молекулярную формулу полученного алкана:
![]()
n = 2; молекулярная формула алкана С2Н6
Известно, что исходное вещество относится к классу солей, то есть - это соль карбоновой кислоты, в функциональной группе содержится два атома кислорода. Учитываем условие равенства числа атомов кислорода и углерода и установим структурную формулу исходного органического вещества:
NaOOC-CH2-CH2-COONa
Составим уравнение реакции сплавления исходного органического вещества с гидроксидом натрия:
![]()
Пример 30. Некоторая предельная карбоновая одноосновная кислота массой 6 г требует для полной этерификации такой же массы спирта. При этом получается 10,2 г сложного эфира. Установите молекулярную формулу кислоты.
Запишем уравнение реакции этерификации в общем виде:
![]()
Вычислим массу и количество вещества воды, учитывая тот факт, что она равна разнице между суммой масс кислоты и спирта и массой образовавшегося сложного эфира:
![]()
Из уравнения реакции следует, что количество моль кислоты равно количеству моль воды:
n(RCOOH) = n(Н2O) = 0,1 моль.
Далее определяем молярную массу кислоты
M(RCOOH) = m/n = 6/0,1 = 60 г/моль Устанавливаем формулу кислоты:
M(R) = 60 - 12 - 32 - 1 = 15 г/моль, следовательно, радикалом является метил -СН3.
Соответственно, молекулярная формула кислоты - СН3СООН.
Задания для самостоятельной работы
85. Определите молекулярную формулу алкена, если известно, что одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, или 5,23 г хлорпроизводного, или 8,2 г бромпроизводного.
86. При сгорании амина выделилось 0,448 л (н.у.) углекислого газа, 0,495 г воды и 0,056 л азота. Установите молекулярную формулу этого амина.
87. При полном сгорании 0,59 г некоторого предельного первичного амина выделилось 0,112 л азота (н.у.). Определите молекулярную формулу этого амина.
88. При взаимодействии 22 г предельного одноатомного спирта с избытком металлического натрия выделилось 2,8 л (н.у.) газа. Определите молекулярную формулу спирта.
89. При сжигании образца некоторого органического соединения массой 14,8 г получено 35,2 г углекислого газа и 18,0 г воды.
Известно, что относительная плотность паров этого вещества по водороду равна 37. В ходе исследования химических свойств этого вещества установлено, что при взаимодействии этого вещества с оксидом меди(II) образуется кетон.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с оксидом меди(II).
90. Сложный эфир массой 30 г подвергнут щелочному гидролизу. При этом получено 34 г натриевой соли предельной одноосновной кислоты и 16 г спирта. Установите молекулярную формулу этого эфира.
91. При сгорании 0,90 г газообразного органического вещества выделилось 0,896 л (н.у.) углекислого газа, 1,26 г воды и 0,224 л азота. Плотность газообразного вещества по азоту 1,607. Установите молекулярную формулу органического вещества.
92. При взаимодействии 25,5 г предельной одноосновной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
93. Некоторый углеводород содержит 12,19% водорода по массе.
Известно, что молекула этого углеводорода содержит один четвертичный атом углерода. Установлено, что этот углеводород может взаимодействовать с аммиачным раствором оксида серебра с образованием бурого осадка.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с аммиачным раствором оксида серебра.
94. Углеводород массой 8,4 г реагирует с водородом в одну стадию и способен присоединить 3,36 л (н.у.) водорода в присутствии катализатора.
Известно, что в результате присоединения бромоводорода к этому углеводороду образуется только одно бромопроизводное.
На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции исходного вещества с бромоводородом.
95. При сгорании 17,5 г органического вещества получили 28 л (н.у.) углекислого газа и 22,5 мл воды. Плотность паров этого вещества (н.у.) составляет 3,125 г/л. Известно также, что это вещество было получено в результате дегидратации третичного спирта.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции получения данного вещества дегидратацией соответствующего третичного спирта.
96. При сгорании 18,8 г органического вещества получили 26,88 л (н.у.) углекислого газа и 10,8 мл воды. Известно, что это вещество реагирует как с гидроксидом натрия, так и с бромной водой.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции данного вещества с бромной водой.
97. Некоторое органическое соединение содержит 69,6% кислорода по массе. Молярная масса этого соединения в 1,586 раза больше молярной массы воздуха. Известно также, что это вещество способно вступать в реакцию этерификации с пропанолом-2.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с пропанолом-2.
98. При сгорании 18,8 г органического вещества получили 26,88 л углекислого газа и 10,8 г воды. Известно также, что вещество взаимодействует с бромной водой с образованием белого осадка. На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с бромной водой.
99. Некоторое органическое соединение содержит 40,0% углерода и 53,3% кислорода по массе. Известно, что это соединение реагирует с оксидом меди(II).
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с оксидом меди(II).