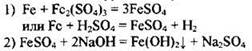Химия ОГЭ - Основной государственный экзамен - Комплекс материалов для подготовки учащихся - Д.Ю. Добротин - 2018 год
Ответы к заданиям для самостоятельной работы - ОТВЕТЫ
|
№ |
1 |
2 |
3 |
4 |
5 |
0 |
7 |
8 |
9 |
10 |
|
ответ |
4 |
3 |
3 |
2 |
1 |
4 |
3 |
4 |
1 |
4 |
|
№ |
11 |
12 |
13 |
14 |
15 |
10 |
17 |
18 |
19 |
20 |
|
ответ |
1 |
2 |
3 |
1 |
3 |
1 |
4 |
2 |
1 |
1 |
|
№ |
21 |
22 |
23 |
24 |
25 |
20 |
27 |
28 |
29 |
30 |
|
ответ |
1 |
2 |
4 |
4 |
2 |
4 |
1 |
1 |
2 |
2 |
|
№ |
31 |
32 |
33 |
34 |
35 |
30 |
37 |
38 |
39 |
40 |
|
ответ |
3 |
3 |
2 |
4 |
3 |
4 |
4 |
3 |
3 |
2 |
|
№ |
41 |
42 |
43 |
44 |
45 |
40 |
47 |
48 |
49 |
50 |
|
ответ |
2 |
2 |
3 |
4 |
4 |
4 |
1 |
1 |
2 |
3 |
|
№ |
51 |
52 |
53 |
54 |
55 |
50 |
57 |
58 |
59 |
00 |
|
ответ |
3 |
4 |
1 |
1 |
1 |
4 |
2 |
4 |
1 |
4 |
|
№ |
61 |
62 |
03 |
04 |
05 |
00 |
07 |
08 |
09 |
70 |
|
ответ |
3 |
3 |
2 |
1 |
3 |
4 |
1 |
1 |
2 |
3 |
|
№ |
71 |
72 |
73 |
74 |
75 |
70 |
77 |
78 |
79 |
80 |
|
ответ |
3 |
3 |
3 |
4 |
2 |
1 |
2 |
2 |
3 |
3 |
|
№ |
81 |
82 |
83 |
84 |
85 |
80 |
87 |
88 |
89 |
90 |
|
ответ |
23 |
35 |
15 |
12 |
45 |
14 |
23 |
12 |
35 |
15 |
|
№ |
91 |
92 |
93 |
94 |
95 |
90 |
97 |
98 |
99 |
100 |
|
ответ |
13 |
15 |
14 |
13 |
15 |
35 |
4 |
2 |
1 |
4 |
|
№ |
101 |
102 |
103 |
104 |
105 |
100 |
107 |
108 |
109 |
110 |
|
ответ |
4 |
1 |
2 |
3 |
4 |
1 |
2 |
3 |
2 |
2 |
|
№ |
111 |
112 |
113 |
114 |
115 |
110 |
117 |
118 |
119 |
120 |
|
ответ |
2 |
1 |
3 |
1 |
3 |
3 |
4 |
1 |
1 |
1 |
|
№ |
121 |
122 |
123 |
124 |
125 |
120 |
127 |
128 |
129 |
130 |
|
ответ |
4 |
3 |
1 |
3 |
2 |
3 |
2 |
4 |
2 |
3 |
|
№ |
131 |
132 |
133 |
134 |
135 |
130 |
137 |
138 |
139 |
140 |
|
ответ |
4 |
2 |
3 |
4 |
4 |
1 |
4 |
3 |
1 |
2 |
|
№ |
141 |
142 |
143 |
144 |
145 |
140 |
147 |
148 |
149 |
150 |
|
ответ |
3 |
4 |
2 |
3 |
1 |
2 |
2 |
2 |
1 |
3 |
|
№ |
151 |
152 |
153 |
154 |
155 |
150 |
157 |
158 |
159 |
160 |
|
ответ |
2 |
1 |
1 |
3 |
4 |
312 |
243 |
423 |
231 |
132 |
|
№ |
161 |
162 |
103 |
104 |
105 |
100 |
107 |
108 |
109 |
170 |
|
ответ |
421 |
223 |
412 |
142 |
243 |
123 |
214 |
242 |
421 |
312 |
|
№ |
171 |
172 |
173 |
174 |
175 |
170 |
177 |
178 |
179 |
180 |
|
ответ |
231 |
3 |
4 |
1 |
1 |
2 |
3 |
2 |
1 |
4 |
|
№ |
181 |
182 |
183 |
184 |
185 |
180 |
187 |
188 |
189 |
190 |
|
ответ |
1 |
2 |
4 |
4 |
1 |
4 |
2 |
3 |
2 |
1 |
|
№ |
191 |
192 |
193 |
194 |
195 |
190 |
197 |
198 |
199 |
200 |
|
ответ |
3 |
4 |
2 |
3 |
2 |
4 |
3 |
3 |
1 |
2 |
|
№ |
201 |
202 |
203 |
204 |
205 |
200 |
207 |
208 |
209 |
210 |
|
ответ |
1 |
2 |
3 |
3 |
4 |
2 |
3 |
2 |
1 |
2 |
|
№ |
211 |
212 |
213 |
214 |
215 |
210 |
217 |
218 |
219 |
220 |
|
ответ |
1 |
1 |
3 |
4 |
2 |
1 |
1 |
4 |
2 |
4 |
|
№ |
221 |
222 |
223 |
224 |
225 |
220 |
227 |
228 |
229 |
230 |
|
ответ |
2 |
1 |
3 |
1 |
4 |
1 |
3 |
1 |
2 |
4 |
|
№ |
231 |
232 |
233 |
234 |
235 |
230 |
237 |
238 |
239 |
240 |
|
ответ |
2 |
1 |
1 |
4 |
1 |
3 |
3 |
2 |
3 |
1 |
|
№ |
241 |
242 |
243 |
244 |
245 |
240 |
247 |
248 |
249 |
250 |
|
ответ |
4 |
2 |
2 |
1 |
1 |
35 |
45 |
35 |
24 |
34 |
|
№ |
251 |
252 |
253 |
254 |
255 |
250 |
257 |
258 |
259 |
200 |
|
ответ |
25 |
13 |
14 |
15 |
15 |
214 |
413 |
432 |
341 |
423 |
|
№ |
261 |
262 |
263 |
264 |
265 |
266 |
267 |
268 |
269 |
270 |
|
ответ |
412 |
241 |
314 |
241 |
423 |
422 |
314 |
521 |
441 |
352 |
|
№ |
271 |
272 |
273 |
274 |
275 |
276 |
277 |
278 |
279 |
280 |
|
ответ |
214 |
353 |
241 |
231 |
412 |
124 |
214 |
РО1 |
РО |
РО |
|
№ |
291 |
292 |
293 |
294 |
295 |
296 |
297 |
298 |
299 |
300 |
|
ответ |
РО |
РО |
РО |
1 |
2 |
3 |
1 |
4 |
3 |
4 |
|
№ |
301 |
302 |
303 |
304 |
305 |
306 |
307 |
308 |
309 |
310 |
|
ответ |
3 |
4 |
2 |
2 |
1 |
2 |
4 |
2 |
4 |
4 |
|
№ |
311 |
312 |
313 |
314 |
315 |
316 |
317 |
318 |
319 |
320 |
|
ответ |
2 |
1 |
1 |
2 |
1 |
2 |
1 |
2 |
4 |
3 |
|
№ |
321 |
322 |
323 |
324 |
325 |
326 |
327 |
328 |
329 |
330 |
|
ответ |
3 |
4 |
3 |
2 |
3 |
3 |
3 |
2 |
1 |
3 |
|
№ |
331 |
332 |
333 |
334 |
335 |
336 |
337 |
338 |
339 |
340 |
|
ответ |
3 |
2 |
1 |
4 |
3 |
3 |
3 |
4 |
4 |
2 |
|
№ |
341 |
342 |
343 |
344 |
345 |
346 |
347 |
348-380 |
||
|
ответ |
4 |
3 |
3 |
3 |
2 |
2 |
1 |
РО |
||
1РО — задания с развернутым ответом. Ответы на эти задания приведены после таблицы.
278. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлен электронный баланс:
2) Указано, что бор в степени окисления 0 является восстановителем, а хлор в степени окисления +5 (или НСlO3) - окислителем; 3) Составлено уравнение реакции:
|
|
|
Ответ правильный и полный, содержит все названные выше элементы |
3 |
|
В ответе допущена ошибка только в одном из элементов |
2 |
|
В ответе допущены ошибки в двух элементах |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
3 |
279. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что фосфор в степени окисления +3 (или Р2O3) является восстановителем, а хлор в степени окисления +5 (или НСlO3) - окислителем;
3) Составлено уравнение реакции:
![]()
280. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что сера в степени окисления -2 (или H2S) является восстановителем, а хлор в степени окисления 0 (или Сl2) - окислителем;
3) Составлено уравнение реакции:
![]()
281. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что медь в степени окисления +1 (или Сu2O) является восстановителем, а азот в степени окисления +5 (или HNO3) - окислителем;
3) Составлено уравнение реакции:
![]()
282. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что иод в степени окисления 0 (или I2) является восстановителем, а хлор в степени окисления 0 (или Сl2) - окислителем;
3) Составлено уравнение реакции:
![]()
283. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что железо в степени окисления 0 является восстановителем, а водород в степени окисления +1 (или КОН) - окислителем;
3) Составлено уравнение реакции:
![]()
284. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что сера в степени окисления 0 является восстановителем, а хлор в степени окисления 0 (или Сl2) - окислителем;
3) Составлено уравнение реакции:
![]()
285. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что углерод в степени окисления 0 является восстановителем, а азот в степени окисления +5 (или KNO3) - окислителем;
3) Составлено уравнение реакции:
![]()
286. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что бром в степени окисления -1 или НВr) является восстановителем, а бром в степени окисления +5 (или КВrO3) - окислителем;
3) Составлено уравнение реакции:
![]()
287. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что хлор в степени окисления 0 (Сl2) является и восстановителем, и окислителем;
3) Составлено уравнение реакции:
![]()
288. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что медь в степени окисления 0 является восстановителем, а азот в степени окисления +5 (или HNO3) - окислителем;
3) Составлено уравнение реакции:
![]()
289. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что азот в степени окисления +4 (или NO2) является восстановителем, а кислород в степени окисления 0 (или O2) - окислителем;
3) Составлено уравнение реакции:
![]()
290. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что сера в степени окисления -2 (или H2S) является восстановителем, а азот в степени окисления +5 (или HNO3) - окислителем;
3) Составлено уравнение реакции:
![]()
291. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что иод в степени окисления -1 (или HI) является восстановителем, а азот в степени окисления +3 (или HNO2) - окислителем;
3) Составлено уравнение реакции:
![]()
292. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что сера в степени окисления +4 (или SO2) является восстановителем, а бром в степени окисления 0 (или Вr2) - окислителем;
3) Составлено уравнение реакции:
![]()
293. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
Решение:
1) Составлен электронный баланс:
![]()
2) Указано, что сера в степени окисления -2 (или H2S) является восстановителем, а железо в степени окисления +3 (или Fe2O3) - окислителем;
3) Составлено уравнение реакции:
![]()
348. К 80 г раствора с массовой долей гидроксида натрия 5% добавили избыток раствора сульфата меди(II). Определите массу выпавшего осадка.
Решение:
1) Составлено уравнение реакции:
![]()
2) Рассчитана масса и количество вещества гидроксида натрия, содержащегося в растворе:
![]()
3) Определена масса вещества, выпавшего в осадок: по уравнению реакции
![]()
|
Критерии оценивания |
Балл |
|
Ответ правильный и полный, включает все названные выше элементы |
3 |
|
Правильно записаны два элемента из названных выше |
2 |
|
Правильно записан один из названных выше элементов (1-й или 2-й) |
1 |
|
Все элементы ответа записаны неверно |
0 |
349. К 85 г раствора с массовой долей нитрата серебра 2% добавили избыток раствора хлорида натрия. Определите массу выпавшего осадка.
Решение:
1) Составлено уравнение реакции:
![]()
2) Рассчитана масса и количество вещества нитрата серебра, содержащегося в растворе:
![]()
3) Определена масса вещества, выпавшего в осадок: по уравнению реакции
![]()
350. К 27 г раствора с массовой долей хлорида меди(II) 10% добавили избыток раствора сульфида натрия. Определите массу выпавшего осадка.
Решение:
1) Составлено уравнение реакции:
![]()
2) Рассчитана масса и количество вещества хлорида меди(II), содержащегося в растворе:
![]()
3) Определена масса вещества, выпавшего в осадок: по уравнению реакции
![]()
351. При добавлении к раствору серной кислоты с массовой долей 5% избытка раствора нитрата бария образовался осадок массой 11,65 г. Определите массу исходного раствора серной кислоты.
Решение:
1) Составлено уравнение реакции:
![]()
2) Определено количество вещества серной кислоты:
![]()
По уравнению реакции: ![]()
3) Определена масса раствора серной кислоты:
![]()
352. При добавлении к раствору гидроксида натрия с массовой долей 5% избытка раствора сульфата меди (II) образовался осадок массой 4,9 г. Определите массу исходного раствора щелочи.
Решение:
1) Составлено уравнение реакции:
![]()
2) Определено количество вещества гидроксида натрия:
![]()
По уравнению реакции ![]()
3) Определена масса раствора гидроксида натрия:
![]()
353. К избытку раствора нитрата алюминия добавили 56 г раствора гидроксида калия с массовой долей 6%. Определите массу выпавшего осадка.
1) Составлено уравнение реакции:
![]()
2) Рассчитана масса и количество вещества гидроксида калия, содержащегося в растворе:
![]()
3) Определена масса вещества, выпавшего в осадок: по уравнению реакции
![]()
354. К 106 г раствора с массовой долей фосфата калия 4% добавили избыток раствора хлорида меди (II). Определите массу выпавшего осадка.
Решение:
1) Составлено уравнение реакции:
![]()
2) Рассчитана масса и количество вещества фосфата калия, содержащегося в растворе:
![]()
3) Определена масса вещества, выпавшего в осадок: по уравнению реакции
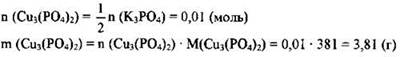
355. К 134 г раствора с массовой долей хлорида меди(II) 2% добавили избыток раствора нитрата серебра. Определите массу выпавшего осадка.
Решение:
1) Составлено уравнение реакции:
![]()
2) Рассчитана масса и количество вещества хлорида меди(II), содержащегося в растворе:
![]()
3) Определена масса вещества, выпавшего в осадок: по уравнению реакции
![]()
356. К 87 г раствора с массовой долей сульфата калия 8% добавили избыток раствора гидроксида бария. Определите массу выпавшего осадка.
Решение:
1) Составлено уравнение реакции:
![]()
2) Рассчитана масса и количество вещества сульфата калия, содержащегося в растворе:
![]()
3) Определена масса вещества, выпавшего в осадок: по уравнению реакции
![]()
357. К 132,4 г раствора с массовой долей нитрата свинца 5% добавили избыток раствора сульфида натрия. Определите массу выпавшего осадка.
Решение:
1) Составлено уравнение реакции:
![]()
2) Рассчитана масса и количество вещества нитрата свинца, содержащегося в растворе:
![]()
3) Определена масса вещества, выпавшего в осадок: по уравнению реакции
![]()
358. К 63,5 г раствора с массовой долей хлорида железа(II) 6% добавили избыток раствора сульфида калия. Определите массу выпавшего осадка.
Решение:
1) Составлено уравнение реакции:
![]()
2) Рассчитана масса и количество вещества хлорида железа(II), содержащегося в растворе:
![]()
3) Определена масса вещества, выпавшего в осадок: по уравнению реакции
![]()
359. При добавлении к раствору хлорида бария с массовой долей 4% избытка раствора сульфата алюминия образовался осадок массой 4,66 г. Определите массу исходного раствора хлорида бария.
Решение:
1) Составлено уравнение реакции:
![]()
2) Рассчитаны количество вещества сульфата бария, выпавшего в осадок и хлорида бария:
![]() по уравнению реакции
по уравнению реакции
![]()
3) Определена масса исходного раствора соли:
![]()
360. При добавлении к раствору нитрата меди(II) с массовой долей 4% избытка раствора гидроксида калия образовался осадок массой 4,9 г. Определите массу исходного раствора соли.
Решение:
1) Составлено уравнение реакции:
![]()
2) Рассчитано количество вещества гидроксида меди(II), выпавшего в осадок и нитрата меди(II):
![]() по уравнению реакции
по уравнению реакции
![]()
3) Определена масса исходного раствора соли:
![]()
361. К 240 г раствора с массовой долей нитрата железа(II) 2% добавили избыток раствора гидроксида натрия. Определите массу выпавшего осадка.
Решение:
1) Составлено уравнение реакции:
![]()
2) Рассчитана масса и количество вещества нитрата железа(II), содержащегося в растворе:
![]()
3) Определена масса вещества, выпавшего в осадок: по уравнению реакции
![]()
362. Через 171 г раствора гидроксида бария с массовой долей 5% пропустили углекислый газ до образования карбоната бария. Вычислите объем (н.у.) вступившего в реакцию газа.
Решение:
1) Составлено уравнение реакции:
![]()
2) Рассчитана масса и количество вещества гидроксида бария, содержащегося в растворе:
![]()
3) Определён объем углекислого газа, вступившего в реакцию: по уравнению реакции
![]()
363. После пропускания через раствор гидроксида калия 1,12 л углекислого газа (н.у.) получили 138 г раствора карбоната калия. Вычислите массовую долю соли в полученном растворе.
Решение:
1) Составлено уравнение реакции:
![]()
2) Рассчитано количество вещества карбоната калия, полученного в результате реакции: ![]()
![]() по уравнению реакции
по уравнению реакции ![]()
3) Определена массовая доля карбоната натрия в растворе:
![]()
364. Для проведения эксперимента предложены следующие реактивы: Fe, Zn; растворы: FeSO4, Fe2(SO4)3, NaOH, H2SO4. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа(II). Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Составлены два уравнения реакции:
Описаны признаки протекания реакций: 3) для первой реакции: растворение металла, изменение цвета раствора; 4) для второй реакции: выпадение серо-зелёного осадка; Составлено сокращённое ионное уравнение второй реакции:
|
|
|
Ответ правильный и полный, содержит все названные элементы |
5 |
|
Правильно записаны четыре элемента ответа |
4 |
|
Правильно записаны три элемента ответа |
3 |
|
Правильно записаны два элемента ответа |
2 |
|
Правильно записан один элемент ответа |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
5 |
365. Для проведения эксперимента предложены следующие реактивы: Al, NH3(p-p); растворы: ВаСl2, Al2(SO4)3, Н2O2, НСl. Используя воду и необходимые вещества только из этого списка, получите в две стадии хлорид алюминия. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выпадение белого осадка;
4) для второй реакции: растворение осадка, и образование прозрачного раствора;
![]()
366. Для проведения эксперимента предложены следующие растворы: NaCl, NH3, НСl, AgNO3, H2O2, лакмуса. Используя воду и необходимые вещества только из этого списка, получите в две стадии хлорид серебра. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: раствор соляной кислоты, окрашенный лакмусом в красный цвет, изменяет окраску на синюю (допускается фраза: “видимых изменений нет”),
4) для второй реакции: выпадение белого осадка;
![]()
367. Для проведения эксперимента предложены следующие реактивы: Сu, Zn, СuО; растворы: Na2SO4, NaOH, СuСl2. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид цинка. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выделение красного осадка металлической меди, изменение цвета раствора;
4) для второй реакции: выпадение белого осадка;
![]()
368. Для проведения эксперимента предложены следующие реактивы: Сu, AgNO3, СuСl2, H2SO4(p-p), NaOH, Н2O2. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди(II). Напишите уравнения реакций. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выделение серого осадка металлического серебра, изменение цвета раствора;
4) для второй реакции: выпадение голубого осадка;
![]()
369. Для проведения эксперимента предложены следующие реактивы: Са(ОН)2(тв); растворы: СаСl2, Ba(NO3)2, HNO3, НСl, Na2CO3. Используя воду и необходимые вещества только из этого списка, получите в две стадии нитрат кальция. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выделение белого осадка;
4) для второй реакции: растворение осадка, выделение бесцветного газа;
![]()
370. Для проведения эксперимента предложены следующие реактивы: Fe; растворы: FeSO4, Fe2(SO4)3, H2SO4, NaOH, Н2O2. Используя воду и необходимые вещества только из этого списка, получите в две стации гидроксид железа(III). Напишите уравнения реакций. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выделение серо-зелёного осадка;
4) для второй реакции: изменение цвета осадка от серо-зеленого до коричневого;
![]()
371. Для проведения эксперимента предложены следующие реактивы: Сu, СuО; растворы: NaCl, AgNO3, HNO3, НСl. Используя воду и необходимые вещества только из этого списка, получите в две стадии хлорид серебра. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: растворение чёрного осадка, и образование прозрачного голубого раствора;
4) для второй реакции: выпадение белого осадка;
![]()
372. Для проведения эксперимента предложены следующие реактивы: Ba(NO3)2, AgNO3, ВаСl2, НСl, СаСO3. Используя воду и необходимые вещества только из этого списка, получите в две стадии нитрат кальция. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение реакции.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выделение газа и растворение осадка;
4) для второй реакции: выпадение белого осадка;
![]()
373. Для проведения эксперимента предложены следующие реактивы: Ba(NO3)2, CuSO4, КСl, КОН, Na2SO4. Используя воду и необходимые вещества только из этого списка, получите в две стадии нитрат калия. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение реакции.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выпадение голубого осадка;
4) для второй реакции: выпадение белого осадка;
![]()
или:
![]()
Признаки протекания реакций:
1) для первой реакции: выпадение белого осадка;
2) для второй реакции: выпадение голубого осадка;
![]()
374. Для проведения эксперимента предложены следующие реактивы: KNO3, MgSO4, ВаСl2, КОН, NaCl. Используя воду и необходимые вещества только из этого списка, получите в две стадии хлорид калия. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для первой реакции напишите сокращённое ионное уравнение реакции.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выпадение белого осадка;
4) для второй реакции: выпадение белого осадка;
![]()
375. Для проведения эксперимента предложены следующие реактивы: AgNO3, ZnSO4, Си, NaOH, раствор H2SO4. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди(II). Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение реакции.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выделение серого осадка и изменение цвета раствора (появление голубой окраски раствора);
4) для второй реакции: выпадение голубого осадка;
![]()
376. Для проведения эксперимента предложены следующие реактивы: AgNO3, CuSO4, MgCl2, NaOH, раствор H2SO4. Используя воду и необходимые вещества только из этого списка, получите в две стадии раствор сульфата магния. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение реакции.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выделение белого осадка;
4) для второй реакции: растворение осадка;
![]()
377. Для проведения эксперимента предложены следующие реактивы: AgNO3, ZnSO4, АlСl3, NaOH, раствор НСl. Используя воду и необходимые вещества только из этого списка, получите в две стадии раствор хлорида цинка. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение реакции.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выделение белого осадка;
4) для второй реакции: растворение осадка;
![]()
378. Для проведения эксперимента предложены следующие реактивы: AgNO3, CuSO4, NaCl, NaOH, раствор HCl. Используя воду и необходимые вещества только из этого списка, получите в две стадии раствор хлорида меди(II). Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение реакции.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выпадение голубого осадка;
4) для второй реакции: растворение осадка, образование раствора сине-зеленого цвета;
![]()
379. Для проведения эксперимента предложены следующие реактивы: AgNO3, CuSO4, ВаСl2, Fe, раствор HCl. Используя воду и необходимые вещества только из этого списка, получите в две стадии раствор хлорида железа(II). Напишите уравнения реакции. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выделение красного осадка и изменение цвета раствора (исчезновение голубой окраски раствора);
4) для второй реакции: выпадение белого осадка;
или
![]()
Признаки протекания реакций:
3) для первой реакции: выпадение белого осадка;
4) для второй реакции: выделение красного осадка металлической меди и изменение цвета раствора (исчезновение голубой окраски раствора);
![]()
380. Для проведения эксперимента предложены следующие реактивы: CuO, FeCl3, Fe, раствор НСl и раствор аммиака (NH3∙H2O). Используя воду и необходимые вещества только из этого списка, получите в две стадии оксид железа(III). Напишите уравнения реакций. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Решение:
![]()
Признаки протекания реакций:
3) для первой реакции: выпадение бурого осадка;
4) для второй реакции: образование красно-коричневого порошка;
![]()