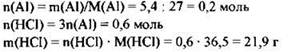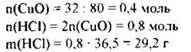Химия ОГЭ - Основной государственный экзамен - Комплекс материалов для подготовки учащихся - Д.Ю. Добротин - 2018 год
Ответы к вариантам - ОТВЕТЫ
|
№ задания |
Номер варианта |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
1 |
3 |
1 |
2 |
4 |
3 |
4 |
3 |
3 |
1 |
2 |
|
2 |
2 |
4 |
2 |
1 |
2 |
4 |
1 |
1 |
4 |
2 |
|
3 |
4 |
4 |
3 |
2 |
4 |
1 |
3 |
2 |
3 |
1 |
|
4 |
1 |
1 |
2 |
3 |
3 |
3 |
4 |
4 |
1 |
4 |
|
5 |
1 |
3 |
3 |
3 |
3 |
1 |
2 |
4 |
2 |
3 |
|
6 |
2 |
1 |
3 |
3 |
1 |
4 |
2 |
1 |
4 |
1 |
|
7 |
2 |
1 |
4 |
1 |
2 |
4 |
2 |
4 |
2 |
1 |
|
8 |
3 |
1 |
1 |
2 |
1 |
2 |
1 |
1 |
4 |
4 |
|
9 |
3 |
2 |
3 |
4 |
2 |
1 |
3 |
2 |
4 |
3 |
|
10 |
4 |
2 |
1 |
3 |
3 |
1 |
4 |
1 |
2 |
1 |
|
11 |
2 |
1 |
4 |
2 |
3 |
4 |
2 |
4 |
2 |
3 |
|
12 |
3 |
4 |
1 |
4 |
1 |
2 |
2 |
1 |
3 |
1 |
|
13 |
4 |
4 |
3 |
4 |
2 |
3 |
2 |
2 |
1 |
3 |
|
14 |
2 |
4 |
3 |
2 |
1 |
2 |
4 |
2 |
1 |
4 |
|
15 |
2 |
3 |
2 |
3 |
2 |
2 |
1 |
4 |
3 |
2 |
|
16 |
23 |
35 |
45 |
14 |
34 |
15 |
34 |
15 |
45 |
35 |
|
17 |
14 |
45 |
15 |
13 |
25 |
23 |
23 |
14 |
15 |
15 |
|
18 |
241 |
121 |
412 |
243 |
411 |
213 |
213 |
241 |
242 |
134 |
|
19 |
413 |
432 |
341 |
423 |
241 |
342 |
314 |
124 |
314 |
341 |
Вариант 1
20. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлен электронный баланс:
2) Указано, что кислород в степени окисления -2 (или NaMnO4) является восстановителем, а марганец в степени окисления +7 (или NaMnO4) - окислителем; 3) Составлено уравнение реакции.
|
|
|
Ответ правильный и полный, содержит все названные выше элементы |
3 |
|
В ответе допущена ошибка только в одном из элементов |
2 |
|
В ответе допущены ошибки в двух элементах |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
3 |
21. В результате взаимодействия растворов нитрата серебра и хлорида калия, взятого в избытке, выпал осадок массой 2,87 г. Вычислите массу исходного раствора нитрата серебра с массовой долей 17%, взятого для реакции.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлено уравнение реакции:
2) Рассчитано количество вещества хлорида серебра:
3) Определены количество вещества и масса раствора нитрата серебра: по уравнению реакции
|
|
|
Ответ правильный и полный, включает все названные элементы |
3 |
|
Правильно записаны 2 элемента из названных выше элементов |
2 |
|
Правильно записан 1 из названных выше элементов (1-й или 2-й) |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
3 |
Для проведения эксперимента предложены следующие реактивы: растворы хлорида натрия, гидроксида натрия, серной кислоты, хлорида бария, металлическое железо.
Используя необходимые вещества только из этого списка, получите в результате двух последовательных реакций хлорид железа(II).
Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение._______________________________
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: Составлены уравнения двух проведённых реакций
Описаны признаки протекания реакций: 3) для первой реакции: выделение бесцветного газа; 4) для второй реакции: выпадение белого осадка; Составлено сокращённое ионное уравнение реакции ионного обмена:
|
|
|
Ответ правильный и полный, содержит все названные элементы |
5 |
|
Правильно записаны четыре элемента ответа |
4 |
|
Правильно записаны три элемента ответа |
3 |
|
Правильно записаны два элемента ответа |
2 |
|
Правильно записан один элемент ответа |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
5 |
Вариант 2
20. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлен электронный баланс:
2) Указано, что иод в степени окисления -1 (или KI) является восстановителем, а бром в степени окисления 0 (или Вr2) - окислителем; 3) Составлено уравнение реакции:
|
21. Вычислите объём углекислого газа, который был поглощён 740 г 0,2%-ного раствора гидроксида кальция, если после окончания реакции был получен прозрачный раствор гидрокарбоната кальция (Са(НСО3)2).
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлено уравнение реакции:
2) Рассчитаны масса и количество вещества гидроксида кальция, содержащегося в растворе:
3) Определён объём углекислого газа, вступившего в реакцию: по уравнению реакции
|
22. Для проведения эксперимента предложены следующие реактивы: растворы серной кислоты, гидроксида кальция, нитрата кальция, нитрата бария, металлическое железо. Используя необходимые вещества только из этого списка, получите в результате двух последовательных реакций раствор нитрата железа(II).
Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: Составлены уравнения двух проведённых реакций
Описаны признаки протекания реакций: 3) для первой реакции: выделение бесцветного газа; 4) для второй реакции: выпадение белого осадка; Составлено сокращённое ионное уравнение реакции ионного обмена:
|
Вариант 3
20. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлен электронный баланс:
2) Указано, что сера в степени окисления 0 является и восстановителем, и окислителем; 3) Составлено уравнение реакции:
|
21. Алюминий массой 5,4 г может прореагировать с 219 г раствора соляной кислоты. Определите процентную концентрацию кислоты в растворе.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлено уравнение реакции:
2) Определена масса НСl, вступившего в реакцию:
3) Рассчитана массовая доля НСl в растворе:
|
22. Для проведения эксперимента предложены следующие реактивы: растворы азотной кислоты, гидроксида натрия, сульфата цинка, нитрата бария, цинк (гранулированный). Используя необходимые вещества только из этого списка, получите в результате двух последовательных реакций раствор нитрата цинка.
Напишите уравнения реакций. Опишите признаки проводимых реакций. Для первой реакции напишите сокращённое ионное уравнение.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: Составлены уравнения двух проведённых реакций
Описаны признаки протекания реакций: 3) для первой реакции: выделение бесцветного газа; 4) для второй реакции: выпадение белого осадка; Составлено сокращённое ионное уравнение реакции ионного обмена:
|
Вариант 4
20. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлен электронный баланс:
2) Указано, что фосфор в степени окисления -3 является восстановителем, а хлор в степени окисления 0 (или Сl2) - окислителем; 3) Составлено уравнение реакции:
|
21. К 34,2 г раствора гидроксида бария с массовой долей щёлочи 5% прилили избыток раствора карбоната калия. Вычислите массу выпавшего осадка.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлено уравнение реакции.
2) Рассчитаны масса и количество вещества гидроксида бария, содержащегося в растворе:
3) Определена масса выпавшего осадка: по уравнению реакции
|
22. Для проведения эксперимента предложены следующие реактивы: растворы соляной кислоты, гидроксида натрия, нитрата натрия, нитрата бария, сульфата железа(II).
Используя необходимые вещества только из этого списка, получите в результате двух последовательных реакций гидроксид железа(II).
Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: Составлены уравнения двух проведённых реакций
Описаны признаки протекания реакций: 3) для первой реакции: выпадение белого осадка; 4) для второй реакции: выпадение серо-зелёного осадка; Составлено сокращённое ионное уравнение реакции ионного обмена:
|
Вариант 5
20. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлен электронный баланс:
2) Указано, что хром в степени окисления 0 является восстановителем, а кислород в степени окисления 0 (или O2) - окислителем; 3) Составлено уравнение реакции:
|
21. Вычислите массу осадка, образовавшегося в результате добавления избытка гидроксида калия к 19 г раствора хлорида магния с массовой долей соли 5%.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлено уравнение реакции:
2) Рассчитаны масса и количество вещества хлорида магния в растворе:
3) Определена масса образовавшегося осадка: по уравнению реакции
|
22. Для проведения эксперимента предложены следующие реактивы: растворы гидроксида натрия, сульфата цинка, хлорида бария, нитрата натрия, хлорида цинка.
Используя необходимые вещества только из этого списка, получите в результате двух последовательных реакций гидроксид цинка.
Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: Составлены уравнения двух проведённых реакций
Описаны признаки протекания реакций: 3) для первой реакции: выпадение белого осадка; 4) для второй реакции: выпадение белого осадка; Составлено сокращённое ионное уравнение реакции ионного обмена:
|
Вариант 6
20. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлен электронный баланс:
2) Указано, что азот в степени окисления -3 (или NH3) является восстановителем, а хром в степени окисления +6 (или СrO3) - окислителем; 3) Составлено уравнение реакции:
|
21. Вычислите объём (н.у.) газа, выделившегося в результате взаимодействия избытка магния со 146 г соляной кислоты с массовой долей НСl 20%.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлено уравнение реакции:
2) Рассчитаны масса и количество вещества соляной кислоты, содержащейся в растворе:
3) Определён объём выделившегося газа: по уравнению реакции
|
22. Для проведения эксперимента предложены следующие реактивы: растворы серной кислоты, азотной кислоты, гидроксида натрия, хлорида кальция, хлорида бария, фенолфталеина. Используя необходимые вещества только из этого списка, получите в результате двух последовательных реакций раствор хлорида натрия.
Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: Составлены уравнения двух проведённых реакций
Описаны признаки протекания реакций: 3) для первой реакции: видимых признаков реакции не наблюдается; 4) для второй реакции: выпадение белого осадка; Составлено сокращённое ионное уравнение реакции ионного обмена:
|
Вариант 7
20. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлен электронный баланс:
2) Указано, что иод в степени окисления -1 (или HI) является восстановителем, а азот в степени окисления +3 (или HNO2) - окислителем; 3) Составлено уравнение реакции:
|
21. После пропускания через раствор гидроксида калия 0,896 л сероводорода (н.у.) получили 220 г раствора сульфида калия. Вычислите массовую долю соли в полученном растворе.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлено уравнение реакции:
2) Рассчитано количество вещества сульфида калия, полученного в результате реакции:
3) Определена массовая доля сульфида калия в растворе:
|
22. Для проведения эксперимента предложены следующие реактивы; растворы соляной кислоты, гидроксида натрия, нитрата натрия, нитрата серебра, фенолфталеина, твердый карбонат кальция.
Используя необходимые вещества только из этого списка, получите в результате двух последовательных реакций раствор нитрата кальция.
Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: Составлены уравнения двух проведённых реакций
Описаны признаки протекания реакций: 3) для первой реакции: выделение газа и растворение осадка; 4) для второй реакции: выпадение белого осадка; Составлено сокращённое ионное уравнение второй реакции:
|
Вариант 8
20. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлен электронный баланс:
2) Указано, что кислород в степени окисления -2 (или AgNO3) является восстановителем, а хлор в степени окисления 0 (или Сl2) - окислителем; 3) Составлено уравнение реакции:
|
21. После пропускания через раствор гидроксида калия 4,48 л сернистого газа (н.у.) получили 252,8 г раствора сульфита калия. Вычислите массовую долю соли в полученном растворе.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлено уравнение реакции:
2) Рассчитано количество вещества сульфита калия, полученного в результате реакции:
по уравнению реакции 3) Определена массовая доля сульфита калия в растворе:
|
22. Для проведения эксперимента предложены следующие реактивы: растворы соляной кислоты, гидроксида кальция, нитрата бария, нитрата серебра, карбоната натрия.
Используя необходимые вещества только из этого списка, получите в результате двух последовательных реакций раствор нитрата натрия.
Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа:
Описаны признаки протекания реакций: 3) для первой реакции: выделение газа; 4) для второй реакции: выпадение белого осадка; Составлено сокращённое ионное уравнение второй реакции:
|
Вариант 9
20. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлен электронный баланс:
2) Указано, что марганец в степени окисления +6 (или К2МnO4) является и восстановителем, и окислителем; 3) Составлено уравнение реакции:
|
21. Вычислите объём углекислого газа (н.у.), который выделится при действии на избыток карбоната кальция 730 г 20%-ного раствора соляной кислоты.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлено уравнение реакции:
2) Рассчитаны масса и количество вещества соляной кислоты, содержащейся в растворе:
3) Определён объём углекислого газа: по уравнению реакции
|
22. Для проведения эксперимента предложены следующие растворы: NaHCO3, Ba(NO3)2, НСl, LiCl, Na2SO4 и H2SO4(KOHЦ).
Используя воду и необходимые вещества только из этого списка, получите в две стадии сульфат бария. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа:
Описаны признаки протекания реакций: 3) для первой реакции: выделение газа; 4) для второй реакции: выпадение белого осадка; Составлено сокращённое ионное уравнение второй реакции:
|
Вариант 10
20. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлен электронный баланс:
2) Указано, что свинец в степени окисления -1 (или НСl) является восстановителем, а свинец в степени окисления +4 (или РbO2) - окислителем: 3) Составлено уравнение реакции:
|
21. Оксид меди(II) массой 32 г может прореагировать с 146 г раствора соляной кислоты. Определите массовую долю кислоты в растворе.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлено уравнение реакции:
2) Определена масса соляной кислоты, вступившей в реакцию:
3) Рассчитана массовая доля НСl в растворе:
|
22. Для проведения эксперимента предложены следующие реактивы: Са(ОН)2(тв); растворы: СаСl2, Ba(NO3)2, HNO3, НСl, Na2CO3.
Используя воду и необходимые вещества только из этого списка, получите в две стадии нитрат кальция. Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа:
Описаны признаки протекания реакций: 3) для первой реакции: выпадение белого осадка; 4) для второй реакции: выделение газа; Составлено сокращённое ионное уравнение второй реакции:
|