Химия - Новый полный справочник для подготовки к ОГЭ - 2018 год
Углеводороды предельные и непредельные: метан, этан, этилен, ацетилен - Первоначальные сведения об органических веществах
Согласно одному из определений, органическая химия — это химия соединений углерода. Действительно, в настоящее время известно более 15 миллионов органических веществ и все они содержат атомы углерода. Лишь такие простейшие соединения углерода, как его оксиды, угольная кислота, карбонаты, галогениды, а также карбиды металлов изучает неорганическая химия.
Простейшие органические соединения — углеводороды. Все остальные органические вещества можно рассматривать как производные углеводородов. Так, есть углеводород метан СН4 — горючее вещество, основа природного газа. Метан можно считать родоначальником целого ряда производных. Заменим один атом водорода на карбоксильную группу —СООН и получим формулу известной вам уксусной кислоты СН3—СООН. Если атом водорода заменить на аминогруппу —NH2, получится метиламин СН3—NH2. Метиловый спирт получается при замене атома водорода в молекуле метана на гидроксогруппу: СН3—ОН. Наконец, можно заместить атом водорода на метильную группу —СН3, при этом образуется новый углеводород — этан СН3—СН3. Поэтому органическую химию можно определить как науку, изучающую углеводороды и их производные.
Причина многообразия органических соединений состоит в удивительной способности атомов углерода соединяться друг с другом с образованием длинных цепей (разветвлённых и нет):
 г
г
а также замкнутых циклов:
Принципиальных отличий между веществами органическими и неорганическими не существует. Тем не менее можно выделить некоторые основные особенности органических веществ. Так, подавляющее большинство из них имеют молекулярное строение, т.е. состоят из отдельных молекул. Следствием этого являются довольно низкие температуры плавления и кипения органических соединений. Химические связи в молекулах органических соединений — ковалентные, в большинстве своём малополярные. Результатом этого является то, что органические вещества, за редким исключением, не являются электролитами.
Все органические вещества горючи, а при нагревании без доступа воздуха разлагаются. Химические реакции с участием органических веществ протекают медленнее, чем с участием веществ неорганических, зачастую требуют нагревания и использования катализаторов. Характерной особенностью реакций с участием органических веществ является одновременное параллельное протекание нескольких возможных процессов. Именно поэтому выход целевого конечного продукта бывает иногда весьма мал. Так, при нагревании оксида углерода(II) и водорода в зависимости от условий можно получить разные продукты:
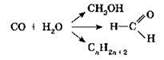
Возможно образование метилового спирта, формальдегида, а также смеси углеводородов, используемой в качестве искусственного бензина. Применение подходящих катализаторов позволяет направить реакцию по нужному пути.
Основные классы органических соединений
Для классификации органических соединений рассматривают как углеродный скелет молекулы, так и находящиеся в молекуле функциональные группы (заместители). Углеродным скелетомназывают последовательность связанных между собой атомов углерода (в некоторых случаях и других атомов) в молекуле. Функциональные группы — это атомы или группы атомов, связанные с углеродным скелетом, определяющие наиболее характерные химические свойства органических веществ.
1. С точки зрения углеродного скелета все органические вещества можно разделить на ациклические (нециклические, алифатические) и циклические.
Ациклические соединения обычно подразделяют на предельные (насыщенные) и непредельные (ненасыщенные) в зависимости от того, отсутствуют или присутствуют в их молекулах кратные углерод-углеродные связи:
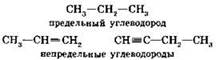
Циклические соединения делят на карбоциклические и гетероциклические. В молекулах карбоциклических соединений цикл образован только атомами углерода. В гетероциклах наряду с атомами углерода присутствуют и другие элементы, например кислород, азот, сера.

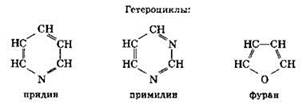
Карбоциклические соединения подразделяют на алициклические и ароматические. Ароматические соединения содержат в своём составе бензольное кольцо.
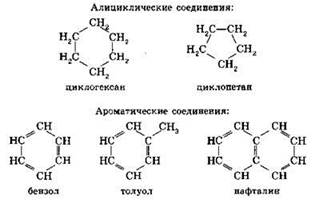
2. В зависимости от функциональной группы все органические соединения подразделяют на классы, важнейшими из которых являются (табл. 6):
Таблица 6
|
Функциональная группа |
Класс |
|
—Cl (F, Br, I) |
Галогенопроизводные |
|
—ОН |
Спирты |
|
|
Альдегиды |
|
|
Карбоновые кислоты |
|
—NO2 |
Нитросоединения |
|
—NH2 |
Амины |
Основы теории строения органических соединений
В 1860-х гг. А.М. Бутлеров сформулировал основные положения, ставшие впоследствии фундаментом теории строения органических соединений. Согласно этой теории:
— атомы в молекулах соединены друг с другом в определённом порядке в соответствии с их валентностями;
— порядок соединения атомов в молекуле называется химическим строением;
— свойства веществ определяются не только их составом, но и химическим строением;
— атомы в молекулах оказывают взаимное влияние друг на друга;
— исходя из строения молекулы, можно предсказать свойства вещества, и наоборот, на основании химических свойств можно предсказать строение вещества.
В органической химии используют следующие виды химических формул: простейшие, молекулярные, структурные.
Простейшие (эмпирические) формулы показывают соотношение атомов элементов в молекуле. Так, в молекуле этана на один атом углерода приходится три атома водорода: СН3. В молекуле этилена на один атом углерода приходится два атома водорода: СН2. В молекуле ацетилена на один атом углерода приходится один атом водорода: СН. Такую же простейшую формулу имеет и бензол.
Молекулярные формулы показывают число атомов каждого элемента в молекуле вещества. Так, молекулярными формулами этана, этилена, ацетилена и бензола являются соответственно:
![]()
Структурные формулы показывают последовательность соединения атомов в молекулах друг с другом, их взаимное расположение (т.е. отражают химическое строение вещества). Для приведённых выше соединений структурные формулы (с учётом четырёхвалентности углерода) записываются так:
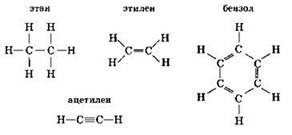
При изучении органической химии широко используют понятия “гомологи” и “изомеры”.
Гомологами называют органические соединения, принадлежащие к одному классу, обладающие сходным строением и свойствами, и отличающиеся друг от друга по составу на одну или несколько групп СН2.
Изомеры — вещества, имеющие одинаковый качественный и количественный состав, но разное строение и разные свойства.
Сравним структурные формулы простейших углеводородов:
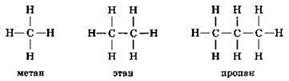
Молекулярная формула метана СН4, этана С2Н6, пропана C3Hg. Видно, что формула этана отличается от формулы метана на одну группу СН2. Аналогично состав молекул пропана и этана также отличается на одну группу СН2. Следовательно, все эти вещества являются гомологами и относятся к гомологическому ряду метана. Прибавив к формуле пропана указанную гомологическую разницу СН2, получим формулу следующего представителя этого гомологического ряда — С4Н10 (бутан):
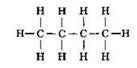
А вот другой пример. Для состава С4Н10 можно изобразить ещё одну структурную формулу:
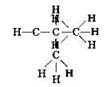
Следовательно, веществ состава С4Н10 должно быть два, каждому из этих веществ соответствует своя структурная формула. Такие вещества, имеющие одинаковый состав, но разное строение, и называются изомерами. Если первое вещество называется бутаном, то второе — изобутаном. Бутан и изобутан — изомеры.
3.4.1. Углеводороды предельные и непредельные: метан, этан, этилен, ацетилен
Познакомимся подробнее с простейшими углеводородами — метаном, этаном, этиленом и ацетиленом. Остальные углеводороды более подробно вы будете изучать в старших классах.
Метан и этан
Метан — простейший углеводород, имеющий состав СН4. Метан часто называют болотным или рудничным газом. Это бесцветный газ без запаха, без вкуса, плохо растворимый в воде, лёгкий — 1 литр его при н.у. условиях имеет массу 0,714 г (т.е. примерно в 1,8 раз легче воздуха).
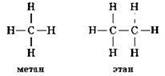
Метан является первым представителем гомологического ряда алканов — углеводородов с общей формулой СnН2n+2. Следующим представителем этого ряда является этан — С2Н6. И метан, и этан относятся к предельным углеводородам, в их молекулах нет кратных связей углерод — углерод и все валентности атомов углерода до предела насыщены атомами водорода:
Рассмотрим пространственное строение молекулы метана. В силу особенностей электронного строения, с которыми вы подробно познакомитесь в старших классах, валентные электронные облака атома углерода в молекулах алканов имеют тетраэдрическую направленность. Это можно отразить в виде следующей геометрической модели:
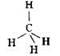
В молекуле метана атом углерода расположен в центре тетраэдра, атомы водорода — в его вершинах. Все валентные углы (углы между линиями связей) одинаковы и равны 109°28ꞌ. Молекула этана представляет собой два тетраэдра, соединённые через общую вершину:
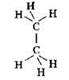
Значения валентных углов в молекуле этана также составляют 109°28'.
Все алканы (в том числе метан и этан) обладают довольно малой химической активностью. Это объясняется тем, что в молекулах алканов нет сильно полярных и кратных химических связей, обладающих повышенной химической активностью. Связи С—С относятся к неполярным ковалентным связям, связи С—Н — к малополярным ковалентным связям.
Важнейшим химическим свойством алканов является реакция горения, сопровождающаяся выделением большого количества теплоты, что позволяет использовать алканы в виде топлива:
![]()
Метан входит в состав природного газа, другие алканы (например, С6Н14, С8Н18) — в состав нефти и жидких продуктов её переработки (бензина, керосина). Смеси метана или этана с воздухом крайне взрывоопасны, что требует особых предосторожностей при работе с этими газами в лаборатории.
Для метана в принципе невозможна реакция присоединения, поскольку в ходе её образовался бы продукт с пятивалентным атомом углерода:
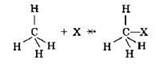
Важнейшим типом реакций для метана и его гомологов являются реакции замещения, в ходе которых один или несколько атомов водорода замещаются на атомы галогенов, нитрогруппу и др.:
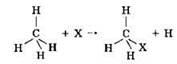
К реакциям замещения относится взаимодействие метана с хлором. В ходе этого взаимодействия происходит последовательное замещение всех атомов водорода на атомы хлора:
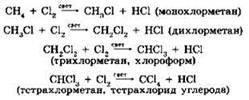
Реакция хлорирования протекает по сложному радикальному цепному механизму, начальной стадией которого является диссоциация молекулы хлора на атомы под действием световой энергии:
![]()
Аналогично протекает взаимодействие метана с азотной кислотой, в ходе этой реакции образуется нитрометан:
![]()
При высокой температуре алканы разлагаются. Характер процесса разложения зависит от природы алкана, температуры и наличия катализатора. Так, метан при нагревании подвергается пиролизу с образованием сажи и водорода:
![]()
При кратковременном нагревании до 1500 °С метан разлагается с образованием ацетилена:
![]()
Этан при нагревании в присутствии катализатора (например, никеля) превращается в этилен:
![]()
Реакции отщепления водорода в органической химии называются реакциями дегидрирования.
Более сложные по составу алканы при воздействии высоких температур подвергаются реакции разложения с разрывом связи углерод—углерод, например:
![]()
Подобные реакции называются крекингом.
Этилен и ацетилен
Этилен С2Н4 и ацетилен С2Н2 относятся к непредельным углеводородам, поскольку валентности атомов углерода не до предела насыщены атомами водорода и в их молекулах имеются кратные углерод-углеродные связи (двойная и тройная, соответственно):
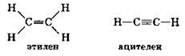
Этилен является первым представителем гомологического ряда алкенов — непредельных углеводородов с общей формулой СnН2n, молекулы которых содержат одну двойную связь. Ацетилен — первый представитель гомологического ряда алкинов — непредельных углеводородов с общей формулой СnН2n-2, молекулы которых содержат одну тройную связь.
Рассмотрим строение молекулы этилена. Каждый атом углерода в ней образует четыре ковалентные связи: две связи углерод-водород и две связи углерод—углерод. Два атома углерода связаны двойной ковалентной связью, одна из которых относится к σ-связям, вторая — к π-связям. В старших классах вы узнаете, что π-связь значительно менее прочная, чем σ-связь, и первой разрывается во многих химических реакциях. За счёт разрыва π-связи для этилена и алкенов возможны реакции присоединения:
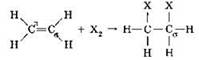
В молекуле ацетилена каждый атом углерода также образует четыре ковалентные связи: одну связь с атомом водорода и три связи с другим атомом углерода. Тройная связь углерод-углерод состоит из одной σ-связи и двух π-связей. В ходе химических реакций две л-связи могут разрываться, поэтому для ацетилена и других алкинов также характерны реакции присоединения:
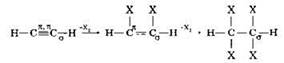
Химическая активность алкенов и алкинов намного больше, чем алканов. Это связано с наличием в молекулах непредельных соединений легко разрываемых π-связей.
И этилен, и ацетилен могут присоединять водород:
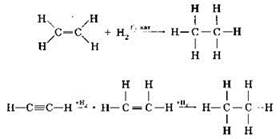
или в виде молекулярных уравнений:
![]()
Реакции присоединения водорода называются реакциями гидрирования. Видно, что при гидрировании ацетилена последовательно образуются сначала этилен, затем этан. Таким образом, при гидрировании непредельные углеводороды (этилен, ацетилен) превращаются в предельные (этан).
Кроме водорода, этилен и ацетилен присоединяют молекулы галогенов. Так, при пропускании газообразного этилена через “бромную воду” (водный раствор брома) последняя обесцвечивается, что является качественной реакцией на непредельные соединения:
![]()
В определённых условиях возможно присоединение молекул галогеноводородов и воды. Для этилена соответствующие реакции запишутся так:
![]()
Реакция присоединения воды называется реакцией гидратации. При гидратации этилена образуется этиловый спирт.
Как и алканы, алкены и алкины горят с выделением большого количества теплоты, например:
![]()
Пламя горящего в кислороде ацетилена развивает температуру до 2500 °С, что позволяет использовать кислородно-ацетиленовую горелку для сварки и резки металлов.
Для непредельных углеводородов возможна реакция полимеризации, в ходе которой из множества отдельных молекул образуется полимер, представляющий собой одну гигантскую макромолекулу. Для этилена уравнение процесса полимеризации можно записать следующим образом:
![]()
В ходе этой реакции из этилена получают важный полимер — полиэтилен.
Задания
Часть 1
К каждому из заданий части 1 даны 4 варианта ответа, из которых только один правильный.
1. К органическим веществам относят
1) оксид углерода(IV.
2) метан .
3) оксид серы(IV)
4) аммиак
2. В молекулах органических веществ химическая связь преимущественно
1) ионная .
2) ковалентна.
3) металлическая
4) водородная
3. Число связей С—Н в молекуле этана равно
1) 5
2) 2
3) 3 .
4) 6
4. К предельным углеводородам относятся все вещества в группе
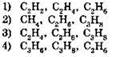
5. К непредельным углеводородам относятся все вещества в группе
![]()
6. Метан реагирует с
1) хлором
2) водородом
3) оксидом углерода(IV)
4) оксидом натрия
7. С каждым из указанных веществ: хлороводород, водород, бромная вода — будет взаимодействовать
1) пропан
2) этилен
3) метан .
4) этан
8. Сколько π-связей присутствует в молекуле пропина?
1) .
2) .
3) .
4) 4
9. Две π-связи содержатся в молекуле
1) этилена .
2) пропана
3) метана .
4) ацетилена
10. С каким из веществ хлор вступает в реакцию замещения на свету?
1) этилен .
2) бензол
3) метан .
4) ацетилен
11. Какое из веществ способно присоединять хлороводород?
1) этан .
2) пропен
3) бензол .
4) бутан
12. При гидрировании алкенов образуются
1) алканы.
2) алкины
3) алкадиен.
4) спирты
При выполнении заданий выберите правильные ответы.
13. Этилен взаимодействует с
1) СO2 .
2) Вr2.
3) Аl(ОН)3
4) НСl.
5) Н2O
6) Са(ОН)2
Ответ: ____ .
(Запишите цифры в порядке возрастания.)
14. Для метана характерны:
1) реакция гидрирования
2) тетраэдрическая форма молекулы
3) наличие π-связи в молекуле
4) плотность меньше воздуха
5) реакции с галогеноводородами
6) горение на воздухе
Ответ: ____ .
(Запишите цифры в порядке возрастания.)