Химия - Универсальный справочник школьника подготовка к ЕГЭ
Галогены (фтор, хлор, бром, йод) и их соединения - Особенности свойств водорода, хлора, брома, йода, кислорода, серы, азота, фосфора, углерода, кремния и их соединений - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Строение и свойства галогенов
Элементы главной подгруппы VII группы периодической системы, объединенные под общим названием галогены, фтор (F), хлор (Cl), бром (Br), иод (I), астат (At) (редко встречающийся в природе) — типичные неметаллы. Это и понятно, ведь их атомы содержат на внешнем энергетическом уровне семь электронов, и им недостает лишь одного электрона, чтобы завершить его. Атомы этих элементов при взаимодействии с металлами принимают электрон от атомов металлов. При этом возникает ионная связь и образуются соли. Отсюда общее название «галогены», т. е. «рождающие соли».
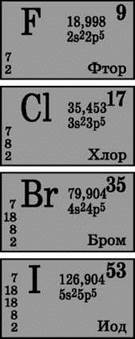
Галогены очень сильные окислители. Фтор в химических реакциях проявляет только окислительные свойства, и для него характерна степень окисления -1. Остальные галогены могут проявлять и восстановительные свойства при взаимодействии с более электроотрицательными элементами — фтором, кислородом, азотом, при этом степени их окисления могут принимать значения +1, +3, +5, +7. Восстановительные свойства галогенов усиливаются от хлора к йоду, что связано с ростом радиусов их атомов: атомов хлора примерно вдвое меньше, чем у йода.
Галогены — простые вещества
Все галогены существуют в свободном состоянии в виде двухатомных молекул с ковалентной неполярной химической связью между атомами. В твердом состоянии F2, Сl2, Br2, I2 имеют молекулярные кристаллические решетки, что и подтверждается их физическими свойствами.
Физические свойства галогенов
С увеличением молекулярной массы галогенов температуры плавления и кипения повышаются, возрастают плотности: бром — жидкость, иод — твердое вещество, фтор и хлор — газы. Это связано с тем, что с увеличением размеров атомов и молекул галогенов возрастают силы межмолекулярного взаимодействия между ними. От F2 к I2 усиливается интенсивность окраски галогенов (табл. 7).
Таблица 7
|
Вещества |
Агрегатное состояние при обычных условиях |
Цвет |
Запах |
t плавления, ос |
t кипения, ос |
|
Фтор F2 |
Газ, не сжижается при обычной температуре |
Светло-желтый |
Резкий, раздражающий |
-220 |
-188 |
|
Хлор Cl2 |
Газ, сжижающийся при обычной температуре под давлением |
Желто-зеленый |
Резкий, удушливый |
-101 |
-34 |
|
Бром Br2 |
Жидкость |
Буровато-коричневый |
Резкий, зловонный |
-7 |
+59 |
|
Иод I2 |
Твердое вещество |
Черно-фиолетовый с металлическим блеском |
Резкий |
+114 |
+186 |
Химические свойства галогенов
Химическая активность галогенов, как неметаллов, от фтора к иоду ослабевает, у кристаллов иода появляется металлический блеск.
Каждый галоген является самым сильным окислителем в своем периоде. Окислительные свойства галогенов отчетливо проявляются при их взаимодействии с металлами. При этом образуются соли. Так, фтор уже при обычных условиях реагирует с большинством металлов, а при нагревании и с золотом, серебром, платиной, известными своей химической пассивностью. Алюминий и цинк в атмосфере фтора воспламеняются:
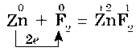
Остальные галогены реагируют с металлами при нагревании. Нагретый порошок железа также загорается при взаимодействии с хлором. Опыт можно провести, как с сурьмой, но только железные опилки нужно предварительно накалить в железной ложечке, а затем высыпать их небольшими порциями в колбу с хлором. Так как хлор является сильным окислителем, то в результате реакции образуется хлорид железа (III):
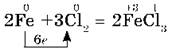
В парах брома сгорает раскаленная медная проволока:
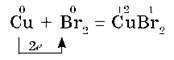
- ЗАПОМНИ. Температуры кипения:
|
Cl2 |
-34 °С, |
|
Br2 |
+59 °С, |
|
I2 |
+186 °С. |
Иод окисляет металлы медленнее, но в присутствии воды, которая является катализатором, реакция иода с порошком алюминия протекает очень бурно:
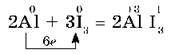
Реакция сопровождается выделением фиолетовых паров иода.
Об уменьшении окислительных и увеличении восстановительных свойств галогенов от фтора к йоду можно судить и по их способности вытеснять друг друга из растворов их солей, а также оно наглядно проявляется при взаимодействии их с водородом. Уравнение этой реакции можно записать в общем виде так:
H2 + Г2 = 2НГ
(Г — условное химическое обозначение галогенов).
Если фтор взаимодействует с водородом в любых условиях со взрывом, то смесь хлора с водородом реагирует только при поджигании или облучении прямым солнечным светом, бром взаимодействует с водородом при нагревании и без взрыва. Эти реакции — экзотермические. Реакция же соединения иода с водородом слабо эндотермическая, она протекает медленно даже при нагревании.
В результате этих реакций образуются соответственно фтороводород HF, хлороводород HCl, бромоводород HBr и иодоводород HI.
Получение галогенов
Фтор и хлор получают электролизом расплавов или растворов их солей. Например, процесс электролиза расплава хлорида натрия можно отразить уравнением:
![]()
При получении хлора электролизом раствора хлорида натрия кроме хлора образуется также водород и гидроксид натрия:
![]()
Галогеноводороды
Все галогеноводороды (общую формулу можно записать как НГ) — бесцветные газы, с резким запахом, токсичны. Очень хорошо растворяются в воде и дымятся во влажном воздухе, т. к. притягивают находящиеся в воздухе водяные пары, образуя при этом туманное облако.
Галогеноводородные кислоты
Растворы галогеноводородов в воде являются кислотами: это HF — фтороводородная, или плавиковая кислота, HCl — хлороводородная, или соляная кислота, HBr — бромоводородная кислота, HI — иодоводородная кислота. Способность их к электролитической диссоциации с образованием катионов водорода растет от HF к HI.
Самая сильная из галогеноводородных кислот — иодоводородная, а самая слабая — фтороводородная. Большая прочность химической связи H—F (поэтому фтороводородная кислота слабо диссоциирует в воде) обусловлена малым размером атома F и соответственно малым расстоянием между ядрами атомов водорода и фтора. С ростом радиуса атома от F к I растет и расстояние H—F, прочность молекул уменьшается и, соответственно, способность к электролитической диссоциации увеличивается.
Наиболее технически важным являются хлороводород и соляная кислота. В промышленности хлороводород получают синтезом из водорода и хлора:
![]()
В лабораторных условиях для получения HCl используют реакцию, проводимую при нагревании:
![]()
Необратимому протеканию этой реакции способствует летучесть HCl.
Соляная кислота представляет собой бесцветную, дымящуюся на воздухе жидкость, она несколько тяжелее воды. Это типичная кислота, взаимодействует с металлами, оксидами металлов, основаниями и солями.
Соляная кислота находит широкое применение в промышленности страны. Ее используют для получения солей, при паянии, для очистки поверхности металлов в гальваностегии, при производстве красок, приготовлении лекарственных препаратов, а также пластмасс и других синтетических материалов.
Соли галогеноводородных кислот
Галогеноводородные кислоты образуют соли: фториды, хлориды, бромиды, иодиды. Хлориды, бромиды и иодиды многих металлов хорошо растворимы в воде.
Для определения в растворе хлорид-, бромид- и иодид-ионов и их различий используют реакцию с нитратом серебра AgNO3. В результате реакции хлоридов (и самой соляной кислоты) с этим реактивом выпадает белый творожистый осадок хлорида серебра, сокращенное ионное уравнение этой реакции записывается так:
![]()
В реакциях с бромоводородной кислотой и ее солями и с иодоводородной кислотой и ее солями также образуются осадки, но только желтого цвета, которые различаются оттенками:
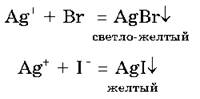
А вот для распознавания фтороводородной кислоты и фторидов нитрат серебра в качестве реактива непригоден, т. к. образующийся AgF растворим в воде. Для доказательства присутствия в растворе фторид-ионов F- можно использовать реакцию с ионами Са2+, поскольку CaF2 выпадает в осадок.
Свое название плавиковая кислота получила из- за уникального свойства взаимодействовать с оксидом кремния (IV), входящим в состав стекла, как бы «плавить» его:
![]()
Эту реакцию используют для изготовления надписей и рисунков на стекле.